下列有关物质性质的比较顺序中,不正确的是
| A.热稳定性:HF<HCl<HBr<HI |
| B.微粒半径:K+>Na+>Mg2+>Al3+ |
| C.酸性:HClO4>H2SO4>H3PO4>H2SiO3 |
| D.熔点:Li>Na>K>Rb |
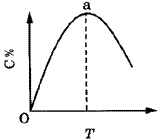
对于可逆反应mA(g)+nB(s) pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p的关系如图所示,请判断下列说法正确的是()。
pC(g)+qD(g)反应过程中,其他条件不变时,产物D的质量分数D%与温度T或压强p的关系如图所示,请判断下列说法正确的是()。
| A.降温,化学平衡向正反应方向移动 |
| B.使用催化剂可使D%有所增加 |
| C.化学方程式中气体的化学计量数m<p+q |
| D.B的颗粒越小,正反应速率越快,有利于平衡向正反应方向移动 |
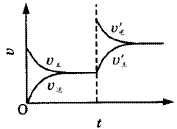
图1表示mA(g)+nB(g) pC(g)+qD(g)+Q,在不同温度下经过一定时间混合体系中C的质量分数与温度T的关系;图2表示在一定条件下达到平衡(v正=v逆)后t时刻改变影响平衡的另一个条件重新建立新平衡的反应过程,判断该反应是( )。
pC(g)+qD(g)+Q,在不同温度下经过一定时间混合体系中C的质量分数与温度T的关系;图2表示在一定条件下达到平衡(v正=v逆)后t时刻改变影响平衡的另一个条件重新建立新平衡的反应过程,判断该反应是( )。
 |
 |
| 图1曲线图 |
图2曲线图 |
| A.m+n>p+qQ>0 |
| B.m+n>p+qQ<0 |
| C.m+n<p+qQ>0 |
| D.m+n<p+qQ<0 |
在一条件下,可逆反应2A(气)+B(气)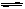 nC(固)+D(气)达平衡。若维持温度不变,增大强压,测得混合气体的平均相对分子质量不变,则下列判断正确的是()
nC(固)+D(气)达平衡。若维持温度不变,增大强压,测得混合气体的平均相对分子质量不变,则下列判断正确的是()
| A.其它条件不变,增大压强,平衡不发生移动 |
| B.其它条件不变,增大压强,混合气体的总质量不变 |
| C.该反应式中n值一定为2 |
D.原混合气中A与B的物质的量之比为2:1,且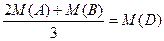 (其中M表示物质的摩尔质量) (其中M表示物质的摩尔质量) |
将8mol H2和2molN2充入2L密闭容器中,在一定条件下进行合成氨反应,4min后反应达到平衡,测得容器中还有5.6molH2。下列计算结果错误的是()
| A.v(H2)="0.3" mol·L-1·min-1 | B.H2的转化率为25% |
| C.NH3的物质的量浓度为0.8mol·L-1 | D.NH3的体积分数为19.05% |
A(气)+3B(气)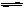 2C(气);△H="+Q" 达平衡后,将气体混和物的温度降低,下列叙述中正确的是()
2C(气);△H="+Q" 达平衡后,将气体混和物的温度降低,下列叙述中正确的是()
| A.正反应速率加大,逆反应速率变小,平衡向正反应方向移动 |
| B.正反应速率变小,逆反应速率加大,平衡向逆反应方向移动 |
| C.正反应速率和逆反应速率变小,平衡向正反应方向移动 |
| D.正反应速率和逆反应速率变小,平衡向逆反应方向移动 |