(8分)已知:①RNH2+R′CH2Cl RNHCH2R′+HCl(R和R′代表烃基)
RNHCH2R′+HCl(R和R′代表烃基)
②苯的同系物能被高锰酸钾氧化,如: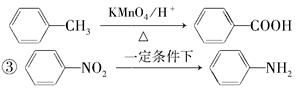
(苯胺,弱碱性,易被氧化)
化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示: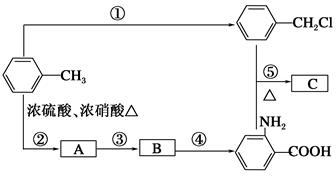
请回答下列问题:
(1)B物质的结构简式是______________________。
(2)写出反应①、②的化学方程式:
①__________________________________________________;
②__________________________________________________。
(3)反应①~⑤中,属于取代反应的是________(填反应序号)。
下图中A—J分别代表有关反应中的一种单质或化合物,其中B、C、D、I均为无色气体。(部分产物和反应条件已略去),若A加热后得到的气体混合物中B和C的物质的量之比为2:1,请回答下列问题: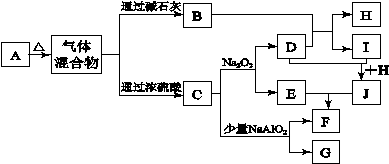
(1)A的化学式为。
(2)实验室检验B的方法是。
(3)写出C和Na2O2反应的化学方程式。
(4)H的电子式为。
(5)若实验室要制备纯净的物质C(可含水蒸气)所需试剂最好选择(填代号);
A.石灰石
B.浓HNO3
C.稀HCl
D.稀H2SO4
E.纯碱
所需气体发生装置是(填代号);所选装置中涉及到的玻璃仪器的名称为。
A—G及X、Y均是中学化学常见物质,其中A是金属氧化物,B、D、E、F、G在常温下为气体且B为红棕色,C是红色的金属单质。它们之间有如下转化关系(其中反应③④⑦的产物中的水已略去)。
(1)写出反应⑤的离子方程式。
(2)写出反应⑦的离子方程式。
(3)写出电解X溶液的阳极反应式。
(4)写出反应④的化学方程式。
(5)若使F按下列途径完全转化为Y,则参加反应的F与整个过程中消耗D的物质的量之比为。
下图中A~K分别代表有关反应的一种反应物或生成物,其中A、C、F、K是固体。已知A是一种不含金属元素的盐,受热分解得到三种产物物质的量之比为2︰1︰1的;A加热后生成的混合气体若通过碱石灰,只剩余气体B(B为无色有刺激性气味的气体),若通过浓硫酸则只剩余气体D(D为无色无味气体);C为淡黄色固体。各物质间的转化关系如下图所示: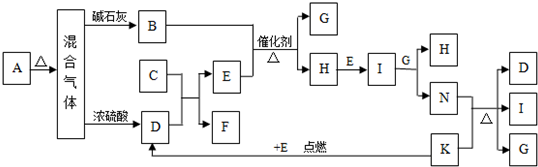
请回答:
(1)D中化学键的类型为________________,C的电子式,B的空间构型为______________。
(2)写出A的溶液与足量NaOH溶液反应的离子方程式:。
(3)写出J与K反应的化学方程。
(4)在标准状况下4.48L的H与I恰好被100mlNaOH溶液完全吸收,所需NaOH溶液的物质的量浓度为mol·L-1。
(5)工业尾气中含有各种氮的氧化物(主要是NO和NO2,表示为NOx),NOx是严重的大气污染物,处理这些废气方法之一是通入适量的B,反应后会生成一种无色无味的气体。写出NOx与B反应的化学方程式: _____________________________________。
某盐X由非金属元素组成,不稳定加热时分解,生成等物质的量的气态氢化物A和B。A、C、E、G、I含有同种元素,C为黄色固体单质。B、D、F、H、J含有同种元素,B可与J反应生成盐。W是具有红色金属光泽的金属。上述物质转化关系如图,部分产物和条件已略去。请回答下列问题:
(1)X的化学式
(2)写出由E生成G的化学反应方程式
(3)写出反应B+Y →D+Z的化学方程式
(4)由E直接转换成I可以加入(填写两种属于不同类别的物质)。
(5)标况下,4.48LA与J的浓溶液反应转移1.6mole-,写出此反应的离子方程式。
(6)将0.1mol/L 100mL I和0.4mol/L 100mL J溶液混合,加入1.92g W,加热,待充分反应后,所得溶液中W金属离子的物质的量浓度为
(14分)化合物A为一种常见金属元素与一种常见非金属元素组成的化合物,阳离子与阴离子的个数比为2:3。K为常见固态非金属单质,J为常见气态单质。其余为化合物,其中I、F在常温下为液态,C为有臭鸡蛋气味气体、D为刺激性气体,H无色无味气体,B为白色胶状沉淀,L为氯碱工业中的常见产品。F的浓溶液与K加热可生成D和H。(部分生成物未标出)
(1)写出H的电子式。
(2)写出下列物质的化学式: E,J。
(3)写出下列变化的化学方程式:
A + I → B + C ;
F的浓溶液与K加热可生成D和H。
(4)写出下列变化的离子方程式:
B中加入L的水溶液;
G的水溶液中通入过量的H。