某元素最高价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为
| A.HX | B.H2X | C.XH3 | D.XH4 |
将炭粉和铁粉均匀混合,撒入内壁分别用氯化钠溶液和稀醋酸溶液润湿过的具支试管中,并按下图装置好仪器,观察下图,示意正确的是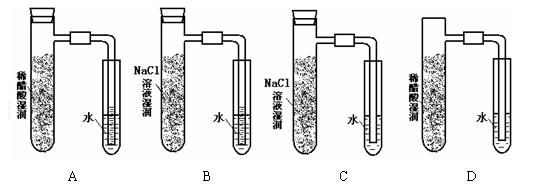
天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钴(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2 + C6 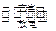 CoO2 + LiC6
CoO2 + LiC6 ,下列说法正确的是
,下列说法正确的是
| A.充电时,电池的负极反应为 LiC6 - e- ="=" Li + C6 |
| B.放电时,电池的正极反应为 CoO2 + Li+ + e- ="=" LiCoO2 , |
| C.羧酸、醇等含活泼氢的有机物可用作锂离子电池的电解质 |
| D.锂离子电池的比能量(单位质量释放的能量)低 |
根据盖斯定律判断下图所示的物质转变过程中,正确的等式是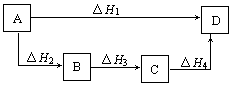
A.△H1=△H2=△H3=△H 4 4 |
B.△H1+△H2=△H3+△H4 |
| C.△H1+△H2+△H3=△H4 | D.△H1=△H2+△H3+△H4 |
对于一定不能自发进行的反应来说,反应后体系的
| A.混乱度减少,而能量增加 | B.混乱度增大,而能量降低 |
| C.混乱度减少,能量降低 | D.混乱度增大,能量增加 |
下列说法或化学用语正确的是(NA表示阿伏加德罗常数)
| A.炽热炭与足量浓硝酸反应离子方程式 C +2H+ +3NO3- ="=CO2" +3NO2↑+H2O |
| B.某无色酸性溶液中含有大量Fe2+ H+ Cl- Ca2+ NO3- |
| C.0.1 mol·L-1的碳酸钠溶液100 mL中含有CO32- 个数小于0.01NA |
| D.少量潮湿空气进入盛有漂白粉的容器中 |
Ca(ClO)2 +2CO2 + 2H2O ="=" 2HClO + Ca(HCO3)2