(1)在CaCl2、KOH、CO2、H2SO4、Na2O2、Na2S中含有离子键的是__________,只含共价键的是__________,既含有离子键又含有共价键的是_____________。
(2)书写下列物质的电子式,
NH4Cl________, CO2__________,
1,3丙二醇是生产新型高分子材料PTT的主要原料,目前1,3丙二醇的生产路线有:以石油裂解气为原料的两条石化合成路线和一条生物工程法合成路线。
【路线1】丙烯醛水合氢化法:
【路线2】环氧乙烷甲酰化法: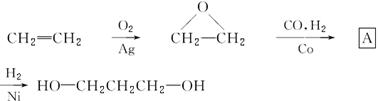
【路线3】生物发酵法:
淀粉 甘油
甘油 1,3丙二醇
1,3丙二醇
(1)A的结构简式为________________。
(2)从合成原料来源的角度看,你认为最具有发展前景的路线是________(填“1”、“2”或“3”),理由是____________________________________________________。
(3)以1,3丙二醇与对苯二甲酸为原料可以合成聚酯PTT,写出其化学方程式_______________。
(4)已知丙二酸二乙酯能发生以下反应: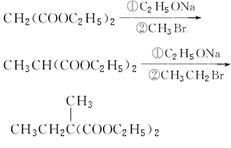 ,利用该反应原理,以丙二酸二乙酯、1,3丙二醇、乙醇为原料合成
,利用该反应原理,以丙二酸二乙酯、1,3丙二醇、乙醇为原料合成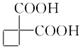 ,请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
,请你设计出合理的反应流程图。提示:①合成过程中无机试剂任选,②合成反应流程图表示方法示例如下:
A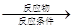 B
B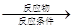 C……
C……
化学工作者十分关注聚氯乙烯(PVC)保鲜膜的安全问题。PVC保鲜膜的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。
(1)工业上用乙烯和氯气为原料经下列各步合成PVC:
乙是PVC的单体,其结构简式为__________________________________________________,
反应①③的化学方程式分别为__________________________________________________、
________________________________________________________________________。
(2)邻苯二甲酸辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸酐(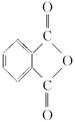 )是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酸酯,其结构简式为
)是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂DMP(分子式为C10H10O4),DMP属于芳香酸酯,其结构简式为
________________________________________________________________________。
现有下列高分子化合物,请从下列各项中选择出最恰当的选项,将代号填入下表。
(1)高分子结构型式示意图: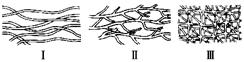
(2)高分子材料的主要性质特点:
| A.具有热塑性 |
| B.可溶于有机溶剂 |
| C.不溶于有机溶剂 |
| D.具有确定的熔点 |
(3)主要应用:(a)用于制备塑料薄膜;(b)用于制备光学仪器;(c)用于制备车辆轮胎
| 硫化橡胶 |
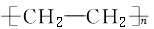 |
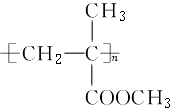 |
|
| (1) |
|||
| (2) |
|||
| (3) |
有机玻璃是日常使用较多的化工产品,用下面的流程可以合成有机玻璃(聚甲基丙烯酸甲酯):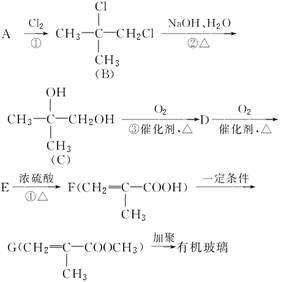
根据上述过程回答下列问题:
(1)A的名称:__________________;写出E的结构简式:________________。
(2)写出上述过程中的反应类型:
②_______________,④________________。
(3)写出③的化学方程式___________________________________。
(4)任写一个G的属于酸的同分异构体的结构简式:
________________________________________________________________________。
某厂以甘蔗为原料制糖,对产生的大量甘蔗渣按下图所示转化进行综合利用。其中B是A水解的最终产物;C的分子式为C3H6O3,一定条件下2个C分子间脱去2个水分子可生成一种六元环状化合物;D可使溴水褪色;H的三聚合物I也是一种六元环状化合物(图中部分反应条件及产物没有列出)。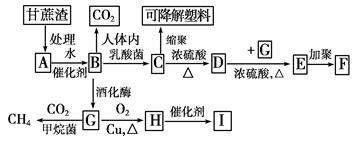
(1)写出下列物质的结构简式:
高分子化合物F________;六元环状化合物I________________________________。
(2)C→D的反应类型为________。D→E的反应类型为________。
(3)写出下列反应的化学方程式:
A→B:________________________________________________________________________。
C→可降解塑料:______________________________________________________________。
(4)H分子所含官能团的名称是________,实验室中常用于检验该官能团的试剂的名称是(只写一种)______________________。
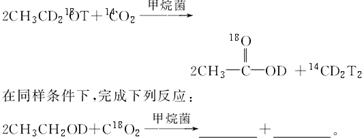
(5)G转变成CH4的反应曾做过如下的同位素示踪实验(D、T为H的同位素):