分子式为C8H8O3的芳香族化合物有多种不同的结构,这些物质在食品、化妆品等行业有广泛用途。
(1)C8H8O3的某一同分异构体尼泊金酯的结构简式如图。
①下列对尼泊金酯的判断不正确的是______。
a.能发生水解反应
b.能与FeCl3溶液发生显色反应
c.分子中所有原子都在同一平面上
d.与浓溴水反应时,1 mol尼泊金酯消耗1 mol Br2
②尼泊金酯与NaOH溶液在一定条件下反应的化学方程式是 ,其中包含的反应类型有 、 。
(2)C8H8O3的另一种同分异构体甲满足以下条件:
①与足量的NaOH溶液完全反应时,1 mol甲消耗3 molNaOH
②遇FeCl3溶液显色③ 苯环上的一氯取代物只有一种,甲可能的结构简式是 、 。
(10分) 自20世纪90年代以来,芳炔类大环化合物的研究发展十分迅速,具有不同分子结构
和几何形状的这一类物质在高科技领域有着十分广泛的应用前景。合成芳炔类大环的一种方法是以苯乙炔(CH≡C- )为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
)为基本原料,经过反应得到一系列的芳炔类大环化合物,其结构为:
(1)上述系列中第1种物质的分子式为。
(2)以苯乙炔(CH≡C- )为基本原料合成芳炔类大环化合物是通过__________反应实现的(填反应类型)。
)为基本原料合成芳炔类大环化合物是通过__________反应实现的(填反应类型)。
(3)已知上述系列第1至第4种物质分别溶解于有机溶剂中,可形成胶体,则分散质的分子直径大约在之间,可通过现象证明所形成的分散系为胶体。
(4)以苯乙炔为基本原料,经过一定反应而得到最终产物。假设反应过程中原料无损失,理论上消耗苯乙炔与所得芳炔类大环化合物的质量比为。
根据下面的反应路线及所给信息填空。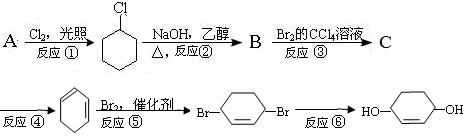


 (1)B的键线式,C的结构简式。
(1)B的键线式,C的结构简式。
(2)在①~⑥的各步反应中,属于取代反应的有,属于加成反应的有
(3)反应④所用的试剂和条件是。
(4)反应③的化学方程式是。
(5)反应④的化学方程式是。
(6)反应⑥的化学方程式是。
(6分)有机物A是合成药物(芬必得)的主要原料,其结构简式为 ,与A具有相同分子式,且苯环上只有一个取代基的有机物共有4种,除A以外还有的3种分别为:
,与A具有相同分子式,且苯环上只有一个取代基的有机物共有4种,除A以外还有的3种分别为:
(6分)按要求填空:
(1)羟基的电子式是
(2)苯酚钠溶液中通入CO2的化学方程式:
(3)苯乙烯与溴的四氯化碳溶液的反应方程式:
(10分)(1)我国酸雨危害十分严重,是世界三大酸雨区之一,且主要为硫酸型酸雨。形成硫酸型酸雨主要是由于空气中含量超标。形成硫酸型酸雨发生的主要反应的化学方程式为
途径一:;
途径二:。
(2)某校科技活动小组的同学采集酸雨样品,每隔一段时间测定样品的pH,得到下列数据:
| 时间 |
开始 |
8 h后 |
16 h 后 |
24 h后 |
32 h后 |
4O h后 |
48 h后 |
| pH |
5.O |
4.8 |
4.5 |
4.3 |
4.2 |
4.O |
4.O |
请根据上述材料,回答下列有关问题:
①酸雨放置时,pH发生变化的主要原因为
(3)你认为减少酸雨产生的途径可采取的措施是
A、用煤作燃料 B、把工厂烟囱造高 C、燃料脱硫 D、开发新能源