在溶液中加入足量的Na2O2后仍能大量共存的离子组是
| A.NH4+、Ba2+、Cl-、NO3- | B.K+、AlO2-、Cl-、SO42- |
| C.Ca2+、Mg2+、NO3-、HCO3- | D.Na+、Cl-、CO32-、SO32- |
下列变化一定需要加入还原剂才能实现的是()
| A.HCO3- →CO2 | B.HCl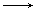 Cl2 Cl2 |
C.KClO3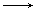 KCl KCl |
D.MnO4-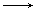 Mn2+ Mn2+ |
下列说法正确的是()
| A.浓硫酸用铜制容器密封保存 | B.SO2能使溴水褪色,体现其漂白性 |
| C.氨气是电解质,因为氨气的水溶液能导电 | D.光导纤维的主要成分是二氧化硅 |
设NA为阿伏伽德罗常数的值,下列说法正确的是()
| A.10mL 18mol/L浓硫酸与足量铜加热充分反应,其中有0.09NA个H2SO4体现了氧化性 |
| B.将5.6g铁在3.36LCl2中点燃,二者一定能恰好完全反应 |
| C.100mL 1mol/L硫酸溶液中,有0.1mol H2SO4分子 |
| D.标准状况下,22.4 L CO2和CO混合气体中含有的碳原子数约为NA |
下列实验能达到预期目的的是()
| A.检验溶液中是否含有CO32-:滴加稀盐酸,将产生的气体通入澄清石灰水 |
| B.检验溶液中是否含有NH4+:先滴加浓NaOH溶液并加热,再用湿润的红色石蕊试纸 |
| C.检验溶液中是否含有Fe2+:先滴加氯水,再滴加KSCN溶液 |
| D.检验溶液中是否含有SO42-:先滴加氯化钡溶液,再滴加稀盐酸 |
有五种化合物:①Mg(HCO3)2,②Al(OH)3,③Al,④(NH4)2CO3,⑤Al2O3。跟盐酸和NaOH溶液都能反应的物质有()
| A.二种 | B.三种 | C.四种 | D.五种 |