用NA表示阿伏加德罗常数,下列叙述正确的是
| A.标准状况下,22.4L CCl4含有的分子数为 NA |
| B.2.4gMg溶于足量稀盐酸,转移的的电子数为0.1NA |
| C.通常状况下,32gO2与32gO3所含的氧原子数均为2NA |
| D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 的数目为 NA |
化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差,参考下表键能数据和晶体硅与二氧化硅结构模型估算晶体硅在氧气中燃烧生成二氧化硅晶体的热化学方程式:Si(s)+O2(g)=SiO2(s)中,ΔH的值为
| 化学键 |
Si—O |
O==O |
Si—Si |
Si—Cl |
Si—C |
| 键能kJ·mol-1 |
460 |
498.8 |
176 |
360 |
347 |
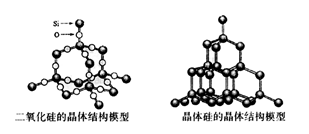
A.- 989.2 kJ·mol-1B.+ 989.2 kJ·mol-1 C.-61.2 kJ·mol-1D.-245.2 kJ·mol-1
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是
| A.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH- |
| B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出 |
| C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出 |
| D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等 |
某同学对未知物A盐的水溶液进行了鉴定,实验过程及现象如图所示: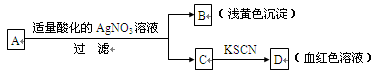
现对A、B、C、D作出的如下推断中,不正确的是
A.盐A一定是FeBr3 B.浅黄色沉淀B是AgBr
C.滤液C中一定含Fe3+ D.D溶液中有Fe(SCN)3
向一容积为1L的密闭容器中加入一定量的X、Y,发生化学反应aX(g)+2Y(s)  bZ(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
bZ(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
根据以上信息,下列说法正确的是
| A.用X表示0~10min内该反应的平均速率为v(X)=0.045mol/L·min |
| B.根据上图可求得方程式中a:b= 1:3, |
| C.推测在第7min时曲线变化的原因可能是升温 |
| D.推测在第13min时曲线变化的原因可能是降温 |
N2O俗称“笑气”,医疗上曾用作可吸入性麻醉剂,下列反应能产生N2O:3CO+2NO23CO2 +N2O。下列关于N2O的说法一定正确的是()
| A.上述反应,每生成lmolN2O,消耗67.2LCO |
| B.等物质的量的N2O和CO2含有相等的电子数 |
| C.N2O只有氧化性,无还原性 |
| D.N2O会迅速与人体血红蛋白结合,使人中毒 |