计算题(共6分) 取4.6g钠投入水中,完全反应后溶液的体积为l升,问:
(1)生成的气体体积在标准状态下为多少升?
(2)所得溶液的物质的量浓度是多少?
为了预防碘缺乏病,国家规定每千克食盐中应含有40~50毫克的碘酸钾。为检验某种食盐是否为加碘的合格食盐,某同学取食盐样品428克,设法溶解出其中全部的碘酸钾。将溶液酸化并加入足量的碘化钾淀粉溶液,溶液呈蓝色,再用0.030mol/L的硫代硫酸钠溶液滴定,用去18.00mL时蓝色刚好褪去。试通过计算说明该加碘食盐是否为合格产品。有关反应如下:
IO3-+5I-+6 H+→3I2+3H2O
I2+2S2O32-→2I-+S4O62-
在标准状态下,1体积水溶解700体积氨气,所得溶液的密度是0.9g/cm3.
求:(1)该氨水溶液的质量分数?(提示:氨水中的溶质为NH3)
(2)该氨水溶液的物质的量浓度
2011年6月,云南曲靖陆良化工实业有限公司5000多吨工业废料铬渣非法倾倒导致当地严重污染。+6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。工业含铬废水的处理方法之一是将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的NaCl后进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3+在阴极区与OH-结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(已知:常温下Ksp Fe(OH)3=2.6×10-39,Ksp Cr(OH)3=6.0×10-31)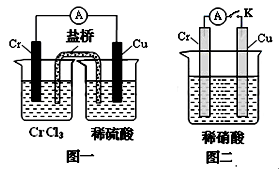
(1)若阳极铁质量减少16.8g,则理论上被还原的Cr2O72-的物质的量为mol。
(2)已知电解后的溶液中c(Fe3+)为2.6×10-13 mol·L-1,则溶液中Cr3+浓度为mol·L-1。
(3)在下图装置中,观察到图一装置铜电极上产生大量的无色气泡,而在图二装置中当开关K断开时,铬电极无现象,K闭合时,铬电极上产生大量无色气体,并变成红棕色气体。根据上述现象试推测金属铬的两个重要化学性质、 。
向20mL AlCl3溶液中滴入2mol/L NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示: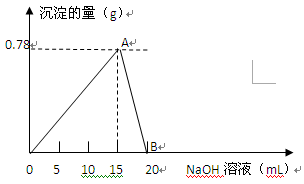
(1)A点表示的意义是。
(2)B点表示的意义是。
(3)假设溶液中有Al(OH)3沉淀0.39g,则此时用去NaOH溶液的体积为
(写出计算过程)。
已知反应CuS +4HNO3=Cu(NO3)2 +2NO2↑+S↓+2H2O,当电子转移电子数为1.806×1023时,被还原的硝酸的物质的量是,氧化产物的质量是,产生标况NO2的体积为。