电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.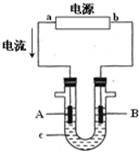
(1)若A、B都是惰性电极,c是饱和NaCl溶液,实验开始时,同时向U型管两边各滴入几滴酚酞试液,试判断
①a是 极(填“正”或“负”);
②写出该池中总反应的离子方程式 .
③A电极上的电极反应式为 ,该反应属于 (填“氧化反应”或“还原反应”)
④B极区附近观察到的现象是 .
(2)如要用电解方法精炼粗铜,电解液c选用CuSO4溶液,则B电极的材料是 ,电极反应式为 .
(3)用惰性电极电解CuSO4溶液.若阴极上析出Cu的质量为3.2g,则阳极上产生的气体在标准状况下的体积为 ;
下列反应属于取代反应的是。
①CH2=CH2+HCl→CH3CH2Cl②Fe+2HCl=FeCl2+H2↑③CH4+Cl2 CH3Cl+HCl
CH3Cl+HCl
④ ⑤CH3COOH+CH3CH2OH
⑤CH3COOH+CH3CH2OH CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
现有A、B、C三种元素,已知B原子序数大于A,A与B的质子数之和为27,质子数之差为5。0.9gC单质与足量盐酸作用放出标准状况时1.12L氢气,同时生成C的三氯化物。回答下列问题。
⑴A是______________,B是______________,C是______________。
⑵A、B、 C三种元素最高价氧化物对应的水化物酸性渐强碱性渐弱的顺序是(写化学式)
⑶A、B、C三种元素的最高价氧化物对应的水化物之间可以发生反应,其离子方程式。
短周期的3种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3化合物。请回答:
⑴X元素的名称是;Y元素的名称是;Z元素的名称是。
⑵XZ3化合物的分子式是,电子式是。
⑶分别写出X、Y的含氧酸的分子式、。
短周期元素X能形成H2X和XO2两种化合物,该元素的原子序数是,位于周期表中的周期族。
新制氯水中含有Cl2、H2O、HClO、H+、Cl-等粒子,根据下列性质选择恰当的粒子进行填空。
(1)使新制氯水呈现浅绿色的物质是 ;
(2)能起杀菌消毒作用,光照易分解的弱酸是 ;
(3)能与硝酸银溶液作用生成白色沉淀的离子是 。