某学生为了探究锌与盐酸反应过程中速率变化,在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
| 时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
50 |
120 |
232 |
290 |
310 |
(1)在0~1、1~2、2~3、3~4、4~5 min各时间段中:反应速率最大的时间段是 ,主要的原因可能是 ;反应速率最小的时间段是 ,原因是 。
(2)在2 ~ 3min时间段内,用盐酸的浓度变化表示的反应速率为 。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:
A.蒸馏水
B.Na2SO4溶液
C.NaOH溶液
D.H2SO4溶液
E.Na2CO3溶液
你认为可行的是(填编号) 。
(10分)(1)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
MnCl2+Cl2↑+2H2O,取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
请回答下列问题:
①写出该反应的离子反应方程式_________________________,②反应中被氧化的HCl的物质的量为 ________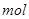 。③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________
。③实验室备用的浓盐酸质量分数为36.5%,密度为1.19 g·cm-3,为使用方便,请计算出该浓盐酸的物质的量浓度_________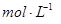 。
。
(2)把一小块镁铝合金溶于100mL盐酸中,然后向其中滴入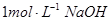 溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。
溶液,生成沉淀的质量和加入NaOH溶液的体积如下图所示。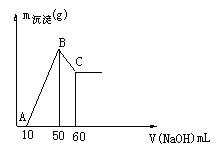
①合金中镁的质量g。
②盐酸的物质的量浓度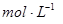 。
。
(10分) A、B、C是单质,其中A是金属,各种物质间的转化关系如图: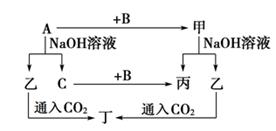
根据图示转化关系回答:
(1)A与NaOH溶液反应的化学方程式________________________________。该反应中的氧化剂是。(填填化学式)
(2)将一定量的A加入到NaOH溶液中,产生的C在标准状况下的体积为6.72 L,则消耗的A的物质的量为________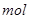 ,转移电子的物质的量为________
,转移电子的物质的量为________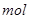 。
。
(3)乙溶液中通入少量CO2反应的离子方程式__________________________。
(10分)已知砒霜As2O3与Zn可以发生如下反应:
As2O3+6Zn+6H2SO4===2AsH3↑+6ZnSO4+3H2O
(1)请用双线桥法标出电子转移的方向和数目。_____________________________。
(2)As2O3在上述反应中显示出来的性质是____________________。
| A.氧化性 | B.还原性 | C.酸性 | D.碱性 |
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为_____________________。
(8分)某固体混合物可能由KCl、NaNO3、K2SO4、FeCl3、CaCl2、K2CO3中的一种或几种混合而成,为鉴定其组成,依次进行如下实验:
(1)混合物中加入足量水得到无色透明溶液;用铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色;
(2)上述溶液中滴加BaCl2有白色沉淀产生;
(3)过滤,然后向上述白色沉淀中加盐酸时,沉淀全部溶解;
(4)往滤液中加AgNO3溶液时有白色沉淀产生且白色沉淀不溶于稀硝酸。
试判断:肯定存在的物质有____________;肯定不存在的物质有_______________________;可能存在的物质有______________________;写出第(4)步实验中发生反应的离子方程式:_____________________。
(12分) 下面是元素周期表的简略框架图。
(1)请在上面元素周期表中画出金属元素与非金属元素的分界线。
按电子排布,可把元素划分成5个区,不全是金属元素的区为__________。
(2)上表中元素①、②原子的最外层电子的电子排布式分别为、;比较元素①与元素②的下列性质(填写“>”或“<”)。
原子半径:①_______②、电负性:①_______②、金属性:①_______②。
(3)某短周期元素最高正价为+7,其原子结构示意图为_____________。
(4)根据氢元素最高正价与最低负价的绝对值相等,你认为可把氢元素放在周期表中的___________族;有人建议将氢元素排在元素周期表的ⅦA族,请你写出支持这一观点的1个化学事实。