室温下,在0.2 mol/LAl2(SO4)3溶液中,逐滴加入1.0 mol/LNaOH溶液,实验测得溶液pH随NaOH溶液体积变化曲线如下图,下列说法正确的是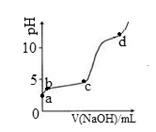
| A.a点,离子方程式为:Al3+ +3OH- ==Al(OH)3↓ |
| B.a~b段,溶液pH增大,促进了氢氧化铝的碱式电离 |
| C.b~c段,加入的OH—主要用于生成Al(OH)3沉淀 |
| D.d点时,Al(OH)3沉淀开始溶解 |
下列说法正确的是()
A.原子序数越大,原子半径一定越大
B.电子层数越多的原子半径一定比电子层数少的原子半径大
C.元素性质的周期性变化不是元素性质的简单重复
D.按C、N、O、F的顺序,元素的最高正化合价依次升高
下列结论错误的是()
①微粒半径:K+>Al3+>S2->Cl-
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I-
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO4
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
| A.只有① | B.①③⑤ | C.②④⑤⑥⑦ | D.②④⑥ |
已知某粒子的结构示意图为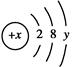 。
。
试回答:
(1)当x-y=10时,该粒子为________(填“原子”“阳离子”或“阴离子”)。
(2)当y=8时,粒子可能为(填粒子符号)______、______、______、______、________。
(3)写出y=3与y=7的元素最高价氧化物对应水化物间发生反应的离子方程式:_________________________________________ _______________________________。
已知一般情况下原子核外最外层电子数相等的元素具有相似的化学性质。氟元素原子的核外电子排布示意图为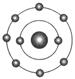 。下列原子中,与氟元素原子的化学性质相似的是()
。下列原子中,与氟元素原子的化学性质相似的是()
核电荷数为1~18的元素中,下列说法正确的是()
| A.最外层只有1个电子的元素一定是金属元素 |
| B.最外层有2个电子的元素一定是金属元素 |
| C.原子核外各层电子数相等的元素一定是金属元素 |
| D.最外层电子数为7的原子,最高正价为+7 |