利用下图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产。下列说法中正确的是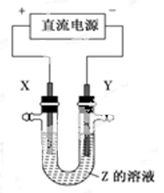
| A.氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 |
| B.铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 |
| C.电镀工业中,X是待镀金属,Y是镀层金属 |
| D.外加电流的阴极保护法中,Y是待保护金属 |
下列反应既是氧化还原反应,又是吸热反应的是( )
| A.铝片与稀H2SO4的反应 |
| B.Ba(OH)2·8H2O与NH4+Cl的反应 |
| C.灼热的炭与CO2的反应 |
| D.甲烷在O2中的燃烧反应 |
已知反应X+Y====M+N为放热反应,对该反应的说法正确的是( )
| A.X的能量一定高于M |
| B.Y的能量一定高于N |
| C.X和Y的总能量一定高于M和N的总能量 |
| D.因为该反应为放热反应,故不必加热就可发生 |
下列对化学反应的认识错误的是()
| A.会引起化学键的变化 |
| B.会产生新的物质 |
| C.必然引起物质状态的变化 |
| D.必然伴随着能量的变化 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn+MnO2+H2O===ZnO+Mn(OH)2
下列说法中,错误的是( )
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为MnO2+2H2O+2e-===Mn(OH)2+2OH- |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g |
以锌片和铜片为两极、稀硫酸为电解液组成原电池,当导线中通过2 mol电子时,下列说法正确的是( )
| A.锌片溶解了1 mol,铜片上析出1 mol氢气 |
| B.两极上溶解和析出的物质的质量相等 |
| C.锌片溶解了1 g,铜片上析出1 g氢气 |
| D.电解质溶液pH不变 |