在一次化学实验中,同学们将饱和硫酸铜溶液逐滴加到5mL饱和氢氧化钠溶液中,观察到以下异常实验现象:
| 实验序号 |
滴加
溶液的量 |
实验现象 |
| ① |
第1~6滴 |
产生蓝色沉淀,但震荡后沉淀消失,形成亮蓝色溶液 |
| ② |
第7~9滴 |
产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
在实验①中同学们根据所学初中化学知识判断蓝色沉淀是氢氧化铜,请你写出生成蓝色沉淀的化学方程式 。
实验①中蓝色沉淀为什么消失?同学们继续进行如下探究。
【查阅资料】
I.氢氧化铜在室温下温度,70℃-80℃时可脱水分解生成氧化铜
II.铜酸钠[
]溶于水,溶液呈亮蓝色。
【猜想与讨论】
小陶认为蓝色沉淀消失可能是氢氧化铜发生了分解。其他同学一致否定了他的猜测,理由是。
同学们交流讨论后,提出以下两种猜想。
猜想一:少许氢氧化铜可溶于足量水中。
猜想二:氢氧化铜可在足量氢氧化钠浓溶液中溶解,溶液呈亮蓝色。
【实验探究】
为验证猜想,同学们用氢氧化铜粉末(其它试剂可任选)设计如下实验。请你填写表中的空格。
| 实验序号 |
实验方法与操作 |
实验现象 |
结论 |
| ③ |
将少许
粉末加到5mL蒸馏水中,充分振荡 |
猜想一错误 |
|
| ④ |
猜想二正确 |
【结论与反思】
(1)根据实验,并进一步查阅资料知道,氢氧化铜在氢氧化钠溶液中溶解生成
,反应的化学方程式是。
(2)根据实验可知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,依据的实验现象是。
小娜同学发现厨房中有两瓶无标签的白色粉末,妈妈告诉她是苏打和小苏打。为了鉴别这两瓶白色粉末,小娜各取了一小包并将它们编号为A、B,然后进行实验探究。
【查阅资料】苏打,学名为碳酸钠, 20℃时溶解度为21.6g,其水溶液呈碱性……
小苏打.学名为碳酸氢钠, 20℃时溶解度为9.8g,其水溶液的碱性比碳酸钠溶液的弱……
【实验探究】根据以上信息及学过的知识,小娜进行了以下的实验:
A B
(1)20℃时,将A、B两种物质各6g分别加入到50g蒸馏水中,有白色固体剩余的是;
(2)用pH试纸测得A的溶液pH=10,B的溶液pH=8,则A粉末是; (3)小娜通过计算发现,等质量的碳酸钠与碳酸氢钠与足量的稀盐酸反应,产生的二氧化碳更多,于是设计了下面的实验方案.在U型管中分别加入等质量A、B两种固体,在两支注射器中分别吸入足量稀盐酸,并注入U型管中.请写出碳酸氢钠与稀盐酸反应的化学方程式:。 实验需要观察的现象是。
(3)小娜通过计算发现,等质量的碳酸钠与碳酸氢钠与足量的稀盐酸反应,产生的二氧化碳更多,于是设计了下面的实验方案.在U型管中分别加入等质量A、B两种固体,在两支注射器中分别吸入足量稀盐酸,并注入U型管中.请写出碳酸氢钠与稀盐酸反应的化学方程式:。 实验需要观察的现象是。
【反思提高】(4)小娜想利用上述实验方案进一步探究碳酸钠和碳酸氢钠与盐酸反应的快慢,请从设计方法的角度说明一下是否合理
。
某化学小组对一包干燥的红色粉末组成进行探究。请你参与并回答有关问题。
【教师提醒】它由Cu 、Fe2O3二种固体中的一种或两种组成。
【提出猜想】红色粉末可能的组成有:①只有Cu;
②只有;③是Cu 、Fe2O3的混合物。
【资料获悉】Cu在FeCl3溶液中发生反应:2FeCl3+Cu = 2FeCl2+CuCl2
【实验探究】(1)甲同学取少量红色粉末于试管中,滴加足量稀盐酸,振荡后观察,发现固体全部溶解。甲同学认为可以排除猜想中的①和③,而乙同学认为只能排除猜想①,你认为的观点正确(填“甲”或“乙”)。
(2)丙同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按右下图在通风橱中进行实验。开始时缓缓通入CO气体,过一段时间后再加热使其充分反应。待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却。反应前后称量相关装置和物质的总质量,其数据如下表:
| 反 应 前 |
反 应 后 |
|
| Ⅰ 组 |
玻璃管和红色粉末的总质量为37.3 g |
玻璃管和固体物质的总质量为36.1 g |
| Ⅱ 组 |
洗气瓶和所盛溶液的总质量为180.0 g |
洗气瓶和瓶中物质 的总质量为183.1 g |

【交流讨论】
(1)在装置A中先通CO气体的作用是。
(2)写出A装置中发生反应的化学方程式;实验中观察到A装置中的现象为。
(3)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处?
不需要,。
(答对下面(4)与【反思评价】两小题将奖励4分,但全卷总分不超过60分)
(4)选择组的实验数据计算来确定红色粉末的组成。最终计算结果表明:该红色粉末的组成是猜想中的第组(填序号)。
【反思评价】丁同学指出:从环保角度,上图装置有严重不足之处。你认为应该如何改进?。
化学课后,某班同学在整理实验桌时,发现有一瓶氢氧化钠溶液没有塞橡皮塞,征得老师同意后,开展了以下探究:
【提出问题1】 该氢氧化钠溶液是否变质了呢?
【实验探究1】
| 实 验 操 作 |
实 验 现 象 |
实 验 结 论 |
| 取少量该溶液于试管中,向溶液中滴加稀盐酸,并不断振荡。 |
。 |
氢氧化钠溶液 一定变质了。 |
【提出问题2】 该氢氧化钠溶液是全部变质还是部分变质呢?
【猜想与假设】 猜想1:氢氧化钠溶液部分变质。
猜想2:氢氧化钠溶液全部变质。
【查阅资料】(1)氯化钙溶液呈中性。
(2)氯化钙溶液能与碳酸钠溶液反应:CaCl2+Na2CO3=CaCO3↓+2NaCl
【实验探究2】
| 实 验 步 骤 |
实 验 现 象 |
实 验 结 论 |
| (1)取少量该溶液于试管中,向溶液中滴加过量的氯化钙溶液,并不断振荡。 |
有生成。 |
说明原溶液中一定有碳酸钠。 |
| (2)取步骤(1)试管中的少量上层清液,滴加酚酞溶液。 |
溶液变红色。 |
说明原溶液中一定有。 |
【实验结论】 该氢氧化钠溶液(填“部分”或“全部”)变质。
【反思与评价】(1)氢氧化钠溶液露置于空气中容易变质,请写出相关反应的化学方程式:。
(2)上述【实验探究2】中,小明提出可用氢氧化钙溶液代替氯化钙溶液,你认为该方案(填“可行”或“不可行”)。
【理解与应用】氢氧化钠溶液容易变质,必须密封保存。实验室必须密封保存的药品还有很多,试另举一例:。
小徐同学欲通过实验探究“用酒精灯给物质加热时 ,应该用那一层火焰”,请你帮他完成实验探究过程的设计,并根据实验数据得出结论。
⑴提出问题:用酒精灯给物质加热时,应该用那一层火焰?
⑵作出猜测:
⑶活动过程和记录:取3支试管,各加入3mL水
①将其中一支试管的底部放在酒精灯火焰上方约3cm处加热;
②将另一支试管的底部与灯芯接触加热;③将第三支试管的底部放在外焰部分加热。
记录上述三种情况下将水加热至沸腾所需时间。
| 第1种情况 |
第2种情况 |
第3种情况 |
|
| 所需时间 |
57s |
48s |
25s |
| 结论 |
⑷问题和讨论:
①上述实验三支试管中,各加入3mL水,即要求所取水的量相同,若不相同行吗?为什么?
②若不用以上探究方法,你认为还可以有其他方法吗?若有,请简要叙述操作过程及现象、结论。。
化学兴趣小组的三位同学对蜡烛(主要成分是石蜡)及其燃烧进行了如下探究。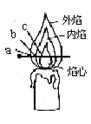
(1)他们观察蜡烛的燃烧,得出下列结论。请回答:
哪些是不需要燃烧就能观察到的现象(填字母)
哪些是需要燃烧才能观察到的现象(填字母)
a.自顶端起约1cm以内的烛体是温的、柔软且易塑型;
b.原料是半透明、微臭、无味白色固体;
c.蜡烛顶端、烛心底部周围有无色液体,呈碗状存在
d.一白色烛心贯穿中轴,并延长至蜡烛顶1cm
e.形状圆柱形,顶部为圆锥形尖出f.烛心周围和烛焰上端呈明亮的黄色
g.吹熄后,见烛心周围有白烟上升,并慢慢消失h.质软,可用指甲刮出痕迹;
i.若风吹至蜡烛一边;另一边碗形顶端的蜡烛将熔成液体并沿烛体落下;
j.如受空气流的影响,火焰会闪动,且生出黑烟。
除此之外,燃烧时你还观察到的现象有(写两点) , 。
(2)在探究蜡烛燃烧的过程中,他们发现罩在火焰上方的烧杯内壁被熏黑,你认为他们的以下做法中,不合适的是()
| A.反复试验,并观察是否有相同现象 |
| B.查找资料,了解石蜡的主要成分,探究生成的黑色固体是什么 |
| C.认为与本次实验目的无关,不予理睬 |
| D.询问老师或同学,讨论生成黑色固体物质的原因 |