氯气和氯乙烯都是非常重要的化工产品,年产量均在107t左右,氯气的实验室制备和氯乙烯的工业生产都有多种不同方法。
完成下列填空:
(1)实验室制取纯净的氯气,除了二氧化锰、浓盐酸和浓硫酸,还需要 、 (填写试剂或溶液名称)
(2)实验室用2.00mol/L盐酸和漂粉精【成分为Ca(ClO)2、CaCl2】反应生产氯气、氯化钙和水,若产生2.24L(标准状况)氯气,发生反应的盐酸盐为 mL。
(3)实验室通常用向上排空气法收集氯气。设计一个简单实验,验证所收集的氯气中是否含有空气。
(4)工业上用电石-乙炔生产氯乙烯的反应如下:CaO+3C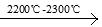 CaC2+CO
CaC2+CO
CaC2+2H2O CH≡CH+Ca(OH)2
CH≡CH+Ca(OH)2
CH≡CH+HCl 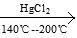 CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖与石油资源。
电石-乙炔法的缺点是: 、 。
(5)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。
设计一种以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。
要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。

I II
⑴ 写出下列仪器的名称:
a. b. c.
⑵ 仪器a~e中,使用前必须检查是否漏水的有。(填序号)
⑶ 若利用装置I分离四氯化碳和酒精的混合物,还缺少的仪器是,将仪器补充完整后进行实验,温度计水银球的位置在处。冷凝水由(填f或g)口通入,口流出。
(4) 现需配制0.125mol/LNaOH溶液450mL,装置II是某同学转移溶液的示意图。
① 图中的错误是。除了图中给出的仪器和分析天平外,为完成实验还需要的仪器有:。
②根据计算得知,需称量NaOH的质量为g。称量时,往左盘烧杯中逐步添加药品至天平平衡,当只缺少量晶体时,其操作方法是_____________________________
② 配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)。
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2~3cm处
④ 下列操作使配制的NaOH溶液浓度偏低的有________.
A.将砝码放在左盘上,NaOH放在右盘上进行称量(使用游码)
B.选用的容量瓶内有少量蒸馏水
C.定容摇匀后,液面下降,又加水至刻度线
D.整个配制过程中,容量瓶不振荡
某同学设计了如下实验探究盐的水解反应规律。
(1)向碳酸钠溶液中滴入几滴酚酞试液,溶液呈红色,用离子方程式表示其原因:
(2)用pH试纸测得硫酸铝溶液的pH为3,用离子方程式表示硫酸铝溶液呈酸性的原因: ;
简述测定该溶液的pH的操作方法是:
(3)将硫酸铝溶液和碳酸氢钠溶液混合,可观察到的现象是生成无色气体和絮状沉淀,写出该反应的离子方程式:
实验室有一瓶固体碳酸钠试剂,其中含有少量的硫酸钠杂质,某学生设计以下实验来确定其纯度。
A称取样品W1 g; B加入过量的盐酸酸化氯化钡溶液;;
C用蒸馏水溶解; D.过滤; E.称量沉淀的质量W2 g;
F.洗涤沉淀; G.干燥沉淀;
(1)正确的操作步骤为:
(2)盐酸酸化的氯化钡溶液要过量的目的是①
②
(3)检验沉淀洗涤干净的方法是
(4)样品中碳酸钠的纯度为
(共16分)选酚酞作指示剂,用中和滴定法测定烧碱样品的纯度(所含杂质不与盐酸反应)。
试根据实验回答:
(1)准确称取4.8g烧碱样品,所用仪器除了药匙,烧杯外,还需有、。
(2)将已称好的样品配成250 mL待测液,需要的仪器除了烧杯,玻璃棒还有、。
(3)用0.2000 mol / L标准盐酸滴定待测烧碱溶液,滴定时边滴边摇动锥形瓶,两眼注视,直到滴定终点。
(4)判断到达滴定终点的实验现象是。
(5)根据下列数据计算,待测烧碱溶液的浓度为。(计算结果保留四位有效数字)
(6)根据上述数据计算,烧碱样品的纯度为
(7) ①如烧碱中杂质能与盐酸反应(如Na2CO3),,则烧碱样品纯度(填“偏高”, “偏低”或“无影响”)
②如果把指示剂由酚酞换成甲基橙,则烧碱样品纯度(填“偏高”, “偏低”或“无影响”)
标准状况下,将224LHCl气体溶于635 mL水中,所得盐酸的密度为1.18 g·cm-3。试计算:(1)所得盐酸的质量分数和物质的量浓度是多少?
(2)取出这种盐酸100 mL,稀释至1.18 L,求所得稀盐酸的物质的量浓度。