下列有关物质的性质或用途的说法正确的是
①氯气具有漂白性,可以直接使有色布条褪色
②二氧化硫具有较强的还原性,不能用浓硫酸干燥
③SiO2是酸性氧化物,能与氢氟酸反应
④Al(OH)3是两性氢氧化物,能溶于强酸或强碱
| A.仅①②③ | B.仅②③④ | C.仅③④ | D.仅①②④ |
下列各组物质之间不可能实现如图所示转化的是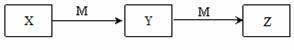
| 选项 |
X |
Y |
Z |
M |
| A |
O2 |
CO2 |
CO |
C |
| B |
CH3CH2OH |
CH3CHO |
CH3COOH |
O2 |
| C |
NaOH |
NaHCO3 |
Na2CO3 |
CO2 |
| D |
NH3 |
NO |
NO2 |
O2 |
在pH=13的溶液中,下列离子能大量共存的是
| A.Na+、NH4+、Cl-、CO32- | B.K+、Ba2+、NO3-、HCO3- |
| C.Na+、K+、SO42-、SiO32- | D.Na+、Cu2+、Br -、AlO2- |
被誉为“百年新药”的阿司匹林的有效成分是乙酰水杨酸,其结构简式如图所示,下列关于乙酰水杨酸的说法中,不正确的是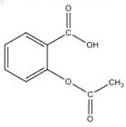
| A.可用于治疗胃酸过多 |
| B.分子式为C9H8O4 |
| C.能与乙醇发生酯化反应 |
| D.能与H2发生加成反应 |
下列说法中,不正确的是
| A.胶体中分散质粒子的直径大小在1~100nm之间 |
| B.可以利用过滤的方法分离胶体和溶液 |
| C.可以利用丁达尔效应区分胶体和溶液 |
| D.胶体在一定条件下能稳定存在 |
下列说法中,正确的是
| A.碳素钢、不锈钢、硬铝、黄铜都属于合金 |
| B.正常雨水的pH为5.6,主要是因为溶解了SO2 |
| C.钢化玻璃常用于制造眼镜片、照相机中的透镜等 |
| D.光化学烟雾主要是由于向大气中任意排放CO2、氟氯烃、SO2等产生的 |