乙烯的产量可以用来衡量一个国家的石油化工发展水平。请回答:
(1)若将乙烯气体通入溴的四氯化碳溶液中,反应的化学方程式为:____________________。
(2)可以用来除去乙烷中混有的乙烯的试剂是______。(填序号)
①水 ②氢气 ③溴的四氯化碳溶液 ④酸性高锰酸钾溶液
(3)在一定条件下,乙烯能与水反应生成有机物A.A的结构简式是_____,其反应类型是______反应(填“取代”或“加成”)。
(4)下列化学反应原理相同的是______(填序号)
①乙烯使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色;
②SO2使溴水和酸性高锰酸钾溶液褪色;
③SO2使品红溶液和滴有酚酞的NaOH溶液褪色;
丙烯是石油化工的重要原料,一定条件下可发生下列转化:
已知: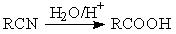

(1)A的结构简式为:____________;
(2)反应④的类型为:_________________反应;
(3)D与足量乙醇反应生成E的化学方程式为:______________________________。
(4) 与足量NaOH溶液反应的化学方程式为____________________。
与足量NaOH溶液反应的化学方程式为____________________。
(5)B的同分异构体有多种.写出其中既能发生银镜反应,又能发生酯化反应的2种同分异构体的结构简式:_______________、___________________。
已知丙烯与水进行加成反应,其可能的产物有两种:(2)下图中E为开链的酯类化合物,其分子式为C6H12O2
请依据上述条件和图中转化关系,在方框中填入合适的化合物的结构简式。
目前在水的净化处理、纸浆的加工等化学工艺中普遍用到一种高分子化合物聚丙烯酰胺。它可由化合物A(分子式C3H6)经以下反应流程制得: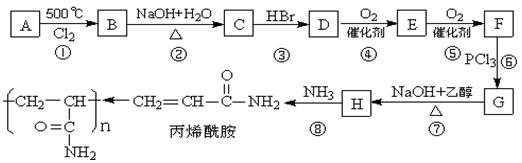
已知:(1)3RCOOH+PCl3 3RCOCl+H3PO3
3RCOCl+H3PO3
(2)RCOCl+NH3 RCONH2+HCl
RCONH2+HCl
试回答下列问题:
(1)写出A和H的结构简式A,H。
(2)关于丙烯酰胺的下列叙述中正确的是:。
| A.能使酸性KMnO4溶液褪色; | B.能发生加聚反应生成高分子化合物; |
| C.与α—氨基乙酸互为同系物; | D.能与H2发生加成反应 |
(3)写出D→E的反应方程式:。
(4)C→D的目的是。
(5)上述反应过程中属于取代反应的是:。
(6)丙烯酰胺有多种同分异构体,同时符合下列要求的同分异构体有多种:
①链状,无碳碳叁键;②同一个碳原子上不能连有2个双键。
试写出其中的2种的结构简式:、。
已知由短周期元素组成的五种常见化合物分子A、B、C、D、E,其所含原子数目依次为2、3、4、5、6,其中A、B、E各含18个电子,C、D各含10个电子。请回答:
(1)D中含有的化学键类型有,若实验测得在25℃、101kPa时,8gD与O2完全燃烧,生成稳定化合物时放出445kJ的热量,则该反应的热化学方程式为。
(2)室温下,向一定量C的稀溶液中逐滴加入A的稀溶液,有离子化合物XY4Z(X、Y、Z表示元素符号)生成,混合液pH变化如图所示。实验过程中,当pH=7时,下列关于混合液中离子浓度判断正确的是。
Ⅰ. c(XY+4)>c(Z—)>c(OH—)=c(H+)
Ⅱ. c(XY+4)=c(Z—),c(OH—)=c(H+)
Ⅲ. c(Z—)>c(XY+4)> c(OH—)=c(H+)
Ⅳ. c(XY+4) + c(H+) = c(Z—) + c(OH—)
(3)XY4Z溶液PH 7(填“小于、等于、大于”),其原因用离子方程式表示为:。
(4)将B缓慢通入Cu(OH)2悬浊液中,浑浊变为黑色,原因是。
(5)E的核磁共振氢谱图中有两组峰,且峰覆盖的面积比为3︰1 ,E的结构式为:。
根据下列流程处理废旧电路板,回收金属M,并制得高效绿色净水剂K2EO4。
据此回答问题:
(1)M的化学式是。 (2)MMSO4过程中,氧化剂是,还原剂是。
(2)MMSO4过程中,氧化剂是,还原剂是。
(3)写出Z→K2EO4的化学反应方程式:。
(4)向Y溶液中滴加KI淀粉溶液,变为蓝色,其原因用离子方程式解释为:。
(5)控制其他条件相同,印刷电路板的金属 M用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下金属M的平均溶解速率(见下表)。
| 温度(℃) |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
| V(M)(x10-3mol.L-1.min-1) |
7.34 |
8.01 |
9.25 |
7.98 |
7.24 |
6.73 |
5.76 |
当温度高于40℃时,M的平均溶解速率随着反应温度升高而下降,其主要原因是。