向5mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色。根据上述变化过程,分析此三种沉淀物的溶解度关系为
| A.AgCl=AgI=Ag2S | B.AgCl<AgI< Ag2S |
| C.AgCl>AgI> Ag2S | D.AgI>AgCI> Ag2S |
烃A分子的立体结构如图(其中C、H原子已略去),因其分子中碳原子排列类似金刚石故名 “金刚烷”,关于金刚烷分子的说法中不正确的是
A.分子中有4个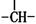 结构
结构
B.分子中有4个由六个碳原子构成的碳环
C.金刚烷分子式是C10H16
D.金刚烷分子的一氯代物有4种
有机物A的结构简式为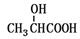 ,它可以通过1~2步反应分别制得B、C、D和E等4种物质。下列说法正确的是
,它可以通过1~2步反应分别制得B、C、D和E等4种物质。下列说法正确的是
A.由A制得B的反应为取代反应
B.物质C和D互为同分异构体
C.物质A、C均可在一定条件下发生聚合反应
D.物质D、E均能发生银镜反应
由短周期前10号元素组成的物质T和X,发生如图所示的转化: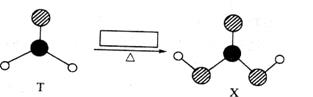
X不稳定,易分解。为使得下列转化能够成功进行,方框内不可能加入的反应试剂是
| A.Ag(NH3)2OH | B.溴水 |
| C.酸性KMnO4溶液 | D.NaOH溶液 |
在核磁共振氢谱中出现两组峰,且其峰面积之比为3∶1的化合物是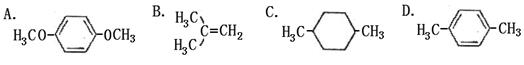
在实验室中,下列除去杂质的方法正确的是
| A.溴苯中混有溴,加入KI溶液,振荡,用汽油萃取出溴 |
| B.乙烷中混有乙烯,通过氢气在一定条件下反应,使乙烯转化为乙烷 |
| C.硝基苯中混有浓HNO3和H2SO4,将其倒入NaOH溶液中,静置,分液 |
| D.乙烯中混有SO2,将其通入酸性高锰酸钾溶液中洗气 |