将3.48克Fe3O4完全溶解在100mL1mol/LH2SO4中,然后加入K2Cr2O7溶液25mL,恰好使溶液中Fe2+全部转化为成Fe3+, Cr2O72-离子全部还原为Cr3+。则K2Cr2O7溶液的摩尔浓度为
| A.0.05mol/L | B.1.0mol/L | C.0.2mol/L | D.0.3mol/L |
下列判断正确的是()
A.0.1mol/L盐酸与0.1mol/L醋酸分别与足量Cu(OH)2反应,反应速率相同
B.0.1mol/L盐酸和0.1mol/LHNO3分别与大小相同的大理石反应,反应速率相同 Mg和Fe与0.1mol/L的盐酸反应,反应速率相同
Mg和Fe与0.1mol/L的盐酸反应,反应速率相同
D.0.1mol/L的盐酸和0.1mol/L的H2SO4分别与Mg反应,反应速率相同
下列各图中,表示正反应是吸热反应的是 ( )
 |
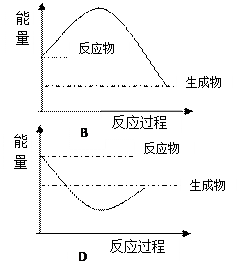 |
||
若甲、丙为短周期、同一主族元素组成的单质,乙、丁都是由两种元素组成的化合物,它们之间有如下图所示的转化关系,则满足条件的甲和丙可以为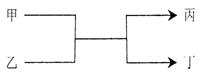
| A.钠和氧气 | B.硫和氧气 |
| C.碳和硅 | D.氯气和溴 |
下列离子方程式不正确的是
| A.氟气通入与氯化钠溶液中: F2+ 2Cl-══ 2F- + Cl2 |
| B.二氧化硅与NaOH溶液反应:SiO2+2OH―══SiO32—+H2O |
| C.铝粉加入稀盐酸中:2Al+6H+══2Al3++3H2↑ |
| D.铝粉加入KOH溶液中:2Al+2OH―+6H2O══2[Al(OH)4]―+3H2↑ |
可用于判断碳酸氢钠粉末中混有碳酸钠的实验方 法是
法是
| A.加热时有无气体放出 |
| B.滴加盐酸时有无气泡放出 |
| C.溶于水后滴加澄清石灰水,有白色沉淀生成 |
| D.溶于水后滴加BaCl2稀溶液,有白色沉淀生成 |