溴化碘(IBr)的化学性质类似于卤素单质,能与大多数金属反应生成金属卤化物,和非金属反应生成相应的卤化物,与水反应的化学方程式为IBr+H2O====HBr+HIO,则下列关于IBr的叙述不正确的是
| A.IBr是共价化合物 |
| B.IBr在很多反应中是强氧化剂 |
| C.IBr跟H2O反应时既不是氧化剂也不是还原剂 |
| D.IBr跟NaOH溶液反应生成NaBrO、NaI和H2O |
乙酸和乙烯的混合物,若其中氧的质量分数为a,则碳的质量分数是
A. (1-a) (1-a) |
B. a a |
C. (1-a) (1-a) |
D.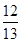 (1-a) (1-a) |
如图是常见四种有机物的比例模型示意图。下列说法正确的是
| A.甲的二氯代物只有一种 |
| B.乙不能与溴水发生取代反应而使溴水褪色 |
| C.1mol丙中含有碳碳双键的数目是3NA |
| D.丁在稀硫酸作用下可与甲酸发生取代反应 |
在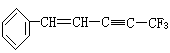 分子中,位于同一平面上的原子数最多可能是
分子中,位于同一平面上的原子数最多可能是
| A.17个 | B.18个 | C.19个 | D.20个 |
研究有机物一般经过以下几个基本步骤:分离、提纯→确定实验式→确定分子式→确定结构式,以下用于研究有机物的方法错误的是
| A.萃取是常用的有机物提纯方法 |
| B.燃烧法是研究确定有机物成分的有效方法之一 |
| C.核磁共振氢谱图通常用于分析有机物的相对分子质量 |
| D.对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 |
分子式为C5H11Cl的同分异构体共有(不考虑立体异构)
| A.6种 | B.7种 | C.8种 | D.9种 |