在25℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积KSP(25℃)如下:
| |
AgCl |
Agl |
Ag2S |
| KSP(单位省略) |
1.8×10-10 |
1.5×10-16 |
1.8×10-50 |
下列论述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度相同
D.25℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度相同
已知甲、乙溶质的质量分数与溶液密度的关系如下表所示:
| 溶质的质量分数 |
甲溶液密度/g.cm-3 |
乙溶液密度g.cm-3 |
| 1% |
0.95 |
1.02 |
| 5% |
0.92 |
1.04 |
| 9% |
0.90 |
1.07 |
甲物质的1%的溶液与9%的溶液等体积混合,乙物质的1%的溶液与9%的溶液等体积混合,下列叙述中,正确的是( )
A.混合后,甲、乙溶液中溶质的质量分数均大于5%
B.混合后,甲溶液中溶质的质量分数大于5%,乙溶液中溶质的质量分数小于5%
C.混合后,乙溶液中溶质的质量分数大于5%,甲溶液中溶质的质量分数小于5%
D.混合后,甲、乙溶液中溶质的质量分数均等于5%
我国青海湖地区素有“夏天晒盐,冬天捞碱”之说。其中捞出的碱主要是碳酸钠和少量氯化钠的混合物。某同学以捞出的碱作为样品,并用下图装置对样品进行分析,根据量瓶中收集到的液体的体积来计算样品中碳酸钠的含量,下列装置中正确的是 ( )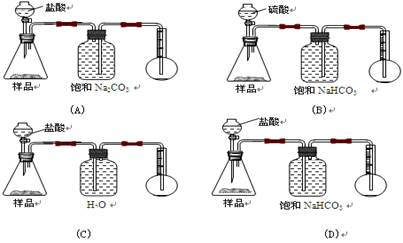
下列离子方程式中正确的是( )
| A.H2SO4与Ba(OH)2溶液反应:Ba2++OH-+H+十SO42-=BaSO4↓+H2O |
| B.NaHCO3与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
| C.Na2CO3溶液中通入少量CO2:CO32-+CO2+H2O=2HCO3- |
| D.CH3COOH溶液与NaOH溶液反应:H++OH-=H2O |
单质Ti的机械强度高,抗蚀能力强,有“未来金属”之称。工业上常用硫酸分解钛铁矿(FeTiO3)的方法来制取TiO2,再由TiO2制金属Ti。由TiO2制金属Ti的反应为( )
① TiO2+2C+2Cl2 ===== TiCl4+2CO② TiCl4+2Mg ===== 2MgCl2+Ti
则下列叙述正确的是
| A.由反应①可知,Cl2是氧化剂,TiCl4是氧化产物 |
| B.由反应①可知,可用CO在高温下把TiO2还原成Ti |
| C.由反应②可知,若有24 g Mg参加反应,就可生成1 mol Ti |
| D.由反应②可知,金属Mg的还原性比金属Ti的还原性强 |
NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A.100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2NA |
| B.标准状况下,22.4 L氦气与22.4 L氟气所含原子数均为2 NA |
| C.100 mL 0.5 mol/L的(NH4)2SO4溶液中,含有0.1NA个NH4+ |
| D.20 g重水(D2O)中含有的电子数为10NA |