(一)氮氧化物是空气的主要污染物,消除氮氧化物污染有多种方法。用催化技术可将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:2NO+2CO 2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
2CO2+N2,为了测定在某种催化剂作用下的反应速率,在某温度下测得不同时间的NO和CO浓度如下表:
| 时间(s) |
0 |
2 |
4 |
| c(NO) ( mol·L-1) |
1.00×10-3 |
2.50×10-4 |
1.00×10-4 |
| c(CO) ( mol·L-1) |
3.60×10-3 |
c’ |
2.70×10-3 |
回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前4s内的平均反应速率v(NO)= 。c’= 。
(2)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,上述反应中二氧化碳浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
①该反应的ΔH 0(填“>”、“<”或“=”)。
②若催化剂的表面积S1>S2,在答题卡图中画出c(CO2) 在T2、 S2条件下达到平衡过程中的变化曲线。
(3)在恒容的密闭容器中,上述反应达到平衡后,改变某一条件,下列示意图正确的是
(二)沉淀溶解平衡也有平衡常数,称为溶度积常数,符号为Ksp,对于某沉淀溶解平衡:
MmAn(s)  mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。M(Ca(OH)2)=74g/mol
mMn+(aq) + nAm-(aq),Ksp=[c(Mn+)]m·[c(Am-)]n。M(Ca(OH)2)=74g/mol
(1)常温时,Fe(OH)3的Ksp=1×10-38,要使溶液中的Fe3+沉淀完全(残留在溶液中的c(Fe3+)<10-5 mol·L-1),则溶液的pH最小为 。
(2)某温度时,在100g水中溶解0.74g Ca(OH)2达到饱和,此时溶液的体积约为100 mL,则该温度下Ca(OH)2的溶度积常数Ksp____________。(写出计算过程)
某温度时,在10L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化下表中数据
| t/min |
X/mol |
Y/mol |
Z/mol |
| 0 |
1.00 |
2.00 |
0.00 |
| 1 |
0.90 |
1.80 |
0.20 |
| 3 |
0.75 |
1.50 |
0.50 |
| 5 |
0.65 |
1.30 |
0.70 |
| 9 |
0.55 |
1.10 |
0.90 |
| 10 |
0.55 |
1.10 |
0.90 |
| 14 |
0.55 |
1.10 |
0.90 |
(1)体系中发生反应的化学方程式是____________;
(2)列式计算该反应在0~3 min时间内产物Z的平均反应速率:________;
(3)该反应达到平衡时反应物X的转化率α等于________;
(4)如果该反应是放热反应,改变实验条件(温度、压强、催化剂)得到Z随时间变化的曲线1、2、3(如下图所示)则曲线1、2、3所对应的实验条件改变分别是:1____________,2______________,3______________。
高温下CuO和CO中发生如下反应:CuO(s)+CO(g) Cu(s)+CO2(g)。
Cu(s)+CO2(g)。
已知该反应在不同温度下的平衡常数如下:
| 温度/℃ |
1 000 |
1 150 |
1 300 |
| 平衡常数 |
4.0 |
3.7 |
3.5 |
请回答下列问题:
(1)该反应的平衡常数表达式K=________,ΔH________0(填“>”“<”或“=”);
(2)在一个容积为10L的密闭容器中,1000℃时加入Cu、CuO、CO、CO2各1.0mol,反应经过10min后达到平衡。求该时间范围内反应的平均反应速率v(CO2)=________、CO的平衡转化率=__;
(3)欲提高(2)中CO的平衡转化率,可采取的措施是__ __。
A.减少Cu的量 B.增加CuO的量 C.移出部分CO2 D.提高反应温度
E.减小容器的容积 F.加入合适的催化剂
将洁净的金属片A、B 、C、D 分别放置在浸有盐溶液的滤纸上面并压紧(如图所示)。在每次实验时,记录电压指针的移动方向和电压表的读数如右表所示: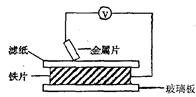
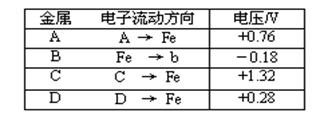
已知构成原电池两电极的金属活动性相差越大,电压表读数越大。请判断:
(1) A、B、C、D四种金属中活泼性最强的是_____________(用字母表示)
(2)若滤纸改用NaOH溶液浸润一段时间后,则在滤纸上能看到有白色物质析出,后迅速变为灰绿色,最后变成褐色。则滤纸上方的金属片为___________(A、B、C、D中哪一种),此时对应的电极反应式为:正极___________________________________________
将1molI2(g)和2molH2置于5L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) 2HI(g) ΔH<0,并达到平衡。HI的体积分数w(HI)随时间变化如曲线(Ⅱ)所示:
2HI(g) ΔH<0,并达到平衡。HI的体积分数w(HI)随时间变化如曲线(Ⅱ)所示: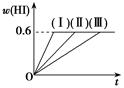
(1)达到平衡时,I2(g)的物质的量浓度为________。
(2)若改变反应条件,在甲条件下w(HI)的变化如曲线(Ⅰ)所示,在乙条件下w(HI)的变化如曲线(Ⅲ)所示。则甲条件可能是____,乙条件可能是________(填入下列条件的序号)。
①恒容条件下,升高温度
②恒容条件下,降低温度
③恒温条件下,缩小反应容器体积
④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当催化剂
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO)∶CO(g)+2H2(g)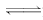 CH3OH(g).
CH3OH(g).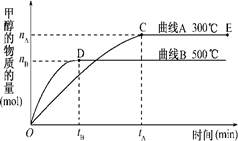
根据题意和所给图象完成下列各题:
(1)反应达到平衡时,平衡常数表达式K=,
(2)升高温度,K值(填“增大”“减小”或“不变”).