关于原子轨道的说法正确的是
| A.凡是中心原子采取sp3杂化轨道成键的分子其几何构型都是正四面体 |
| B.CH4分子中的sp3杂化轨道是由4个H原子的1s 轨道和C原子的2p轨道混合形成 |
| C.sp3杂化轨道是由同一个原子中能量相近的s 轨道和p轨道混合起来形成的一组新轨道 |
| D.凡AB3型的共价化合物,其中中心原子A均采用sp3杂化轨道成键 |
用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是( )
①在外电路中,电流由铜电极流向银电极
②正极反应为Ag++e-=Ag
③实验过程中取出盐桥,原电池仍能继续工作
④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同
| A.①② | B.②③ | C.②④ | D.③④ |
在用Zn片、Cu片和稀H2SO4组成的原电池装置中,工作一段时间后,下列说法中正确的是()
| A.锌片是正极,铜片上有气泡产生 | B.电流方向是从锌片流向铜片 |
| C.溶液中H2SO4的物质的量减少 | D.电解液的pH保持不变 |
电子计算器所用的纽扣式电池为银锌电池,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-=Zn(OH)2、Ag2O+H2O+2e-=2Ag+2OH-.下列叙述中,不正确的是()
| A.电子由锌经导线流向Ag2O |
| B.Zn是正极发生氧化反应;Ag2O是负极发生还原反应 |
| C.Zn是负极,发生氧化反应;Ag2O是正极,发生还原反应 |
| D.工作时,负极区域溶液的pH减小,正极区域溶液的pH增大 |
下列叙述中正确的是( )
| A.构成原电池正极和负极的材料必须是两种金属 |
| B.由Cu、Zn作电极与CuSO4溶液组成的原电池中,Cu是负极 |
| C.马口铁(镀锡铁)破损时与电解质溶液接触,锡先被破坏 |
| D.铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过 |
根据下列实验事实:
(1)X+Y2+ X2++Y
X2++Y
(2)Z+2H2O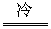 Z(OH)2+H2↑
Z(OH)2+H2↑
(3)Z2+的氧化性比X2+弱
(4)由Y、W作电极组成的原电池反应为:Y-2e- Y2+。
Y2+。
由此可知,X、Y、Z、W的还原性由强到弱的顺序是()
| A.X>Y>Z>W | B.Y>X>W>Z |
| C.Z>X>Y>W | D.Z>Y>X>W |