一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1)向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。①Mn2+基态的电子排布式可表示为 ________。②NO3-的空间构型是________ (用文字描述)。
(2)在铜锰氧化物的催化下,CO被氧化为CO2,HCHO被氧化为CO2和H2O。①根据等电子体原理,CO分子的结构式为________。②H2O分子中O原子轨道的杂化类型为________。③1 mol CO2中含有的σ键数目为________。
(3)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型[Cu(OH)4]2-的结构可用示意图表示为________。
已知CO2(g)+3H2(g) CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
CH3OH(l)+H2O(l) ΔH=-130.9 kJ·mol-1
(1)现将0.8 mol CO2和2.4 mol H2充入容积为20 L的密闭容器中发生上述反应,下列说法正确的是__________(填字母序号)。
| A.该反应在低温下能自发进行 |
| B.当容器内CO2气体体积分数恒定时,该反应已达平衡状态 |
| C.若其他条件不变,实验测得平衡常数:K(T1)>K(T2),则T1<T2 |
| D.现有该反应的X、Y两种催化剂,X能使正反应速率加快约5×105倍、Y能使逆反应速率加快约8×106倍(其他条件相同),故在生产中应该选择X为催化剂更合适 |
(2)该反应进行到45 s时达到平衡,此时CO2的转化率为68.75%。下图1中的曲线表示该反应在前25 s内的反应进程中CO2浓度变化。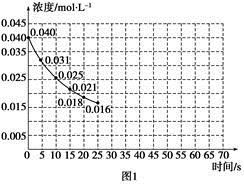
①若反应延续至70 s。请在图1中用实线画出25 s至70 s的反应进程曲线。
②某化学兴趣小组采用实验对比法分析改变实验条件对该反应进程的影响,每次只改变一个条件,并采集反应进程中CO2的浓度变化,在原有反应进程图像上绘制对应的曲线。实验数据如下表:
| 实验 编号 |
CO2起始 浓度/mol·L-1 |
反应温 度/℃ |
反应压 强/kPa |
是否加入 催化剂 |
| A |
0.030 |
150 |
101 |
否 |
| B |
0.040 |
150 |
101 |
否 |
| C |
0.040 |
250 |
101 |
是 |
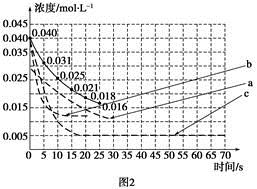
但是该小组负责绘制图线的学生未将曲线(虚线)绘制完整(见图2),也忘记了注明每条曲线所对应改变的条件,请把每个实验编号与图2中对应曲线的字母进行连线。
实验编号 图2中字母
A a
B b
C c
在一固定容积的密闭容器中,保持一定温度,在一定条件下进行以下反应:A(g)+2B(g)  3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
(1)达到平衡时,C在反应混合气中的体积分数是(用含字母a的代数式表示)。
(2)在相同实验条件下,若在同一容器中改为加入2molA和6 mol B,达到平衡后,C的物质的量为mol(用含字母a的代数式表示)。此时C在反应混合气中的体积分数与原平衡相比(选填“增大”“减小”或“不变”)。
(3)在相同实验条件下,若在同一容器中改为加入2 mol A和8 mol B,若要求平衡后C在反应混合气中体积分数仍与原平衡相同,则还应加入Cmol。
(4)在同一容器中加nmolA和3n molB,则平衡时C的物质的量为mmol,若改变实验条件,可以使C的物质的量在m~2m间变化,那么,n与m的关系是_____________。(用字母n、m关系式表示)
一定温度下,在一个10 L密闭容器中发生某可逆反应,其平衡常数表达式为K=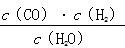 。请回答下列问题。
。请回答下列问题。
(1)该反应的化学方程式为__________________________________________;
若温度升高,K增大,则该反应是________反应(填“吸热”或“放热”)。
(2)能判断该反应一定达到平衡状态的是________(填字母序号)。
| A.v正(H2O)=v逆(H2) |
| B.容器中气体的平均相对分子质量不随时间改变 |
| C.消耗n mol H2的同时消耗n mol CO |
| D.容器中物质的总物质的量不随时间改变 |
(3)该反应的v正随时间变化的关系如图,在t2时改变了某种条件,改变的条件可能是________、________。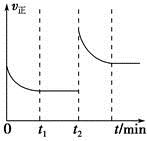
(4)实验测得t2时刻容器内有1 mol H2O(g),5 min后H2O(g)的物质的量是0.8 mol,这5 min内H2O(g)的平均反应速率为________。
面对目前世界范围内的能源危机,甲醇作为一种较好的可再生能源,具有广泛的应用前景。
(1)已知在常温常压下反应的热化学方程式:
①CO(g)+2H2(g)  CH3OH(g) ΔH1=-90 kJ·mol-1
CH3OH(g) ΔH1=-90 kJ·mol-1
②CO(g)+H2O(g)  CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
CO2(g)+H2(g)ΔH2=-41 kJ·mol-1
写出由二氧化碳、氢气制备甲醇的热化学方程式:_______________________。
(2)在容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡时的转化率与温度、压强的关系如图所示。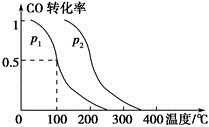
①p1________p2(填“大于”、“小于”或“等于”);
②在其他条件不变的情况下,再增加a mol CO与2a mol H2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”,下同),平衡常数________。
(3)已知在T ℃时,CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________________________
CO2(g)+H2(g)的平衡常数K=0.32,在该温度下,已知c始(CO)=1 mol·L-1,c始(H2O)=1 mol·L-1,某时刻经测定CO的转化率为10%,则该反应________(填“已经”或“没有”)达到平衡,原因是_________________________________________________
此时刻v正________v逆(填“>”或“<”)。
碳及其化合物有广泛的用途。
(1)将水蒸气通过红热的碳即可产生水煤气反应为
C(s)+H2O(g) CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1,
以上反应达到平衡后,在体积不变的条件下,以下措施有利于提高H2O的平衡转化率的是________。(填序号)
| A.升高温度 | B.增加碳的用量 | C.加入催化剂 | D.用CO吸收剂除去CO |
(2)已知:C(s)+CO2(g) 2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g)
2CO(g) ΔH=+172.5 kJ·mol-1,则CO(g)+H2O(g) CO2(g)+H2(g)的焓变ΔH=________。
CO2(g)+H2(g)的焓变ΔH=________。
(3)CO与H2在一定条件下可反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为______________________________________。
CH3OH(g)。甲醇是一种燃料,可利用甲醇设计一个燃料电池,用稀硫酸作电解质溶液,多孔石墨作电极,该电池负极反应式为______________________________________。
若用该电池提供的电能电解60 mL NaCl溶液,设有0.01 mol CH3OH完全放电,NaCl足量,且电解产生的Cl2全部逸出,电解前后忽略溶液体积的变化,则电解结束后所得溶液的pH=________。
(4)将一定量的CO(g)和H2O(g)分别通入到体积为2.0 L的恒容密闭容器中,发生以下反应:CO(g)+H2O(g) CO2(g)+H2(g)。得到如下数据:
CO2(g)+H2(g)。得到如下数据:
| 温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所 需时间/min |
||
| H2O |
CO |
H2 |
CO |
||
| 900 |
1.0 |
2.0 |
0.4 |
1.6 |
3.0 |
通过计算求出该反应的平衡常数(结果保留两位有效数字)________。改变反应的某一条件,反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,反应的离子方程式为(用一个离子方程式表示)_________________________
(5)工业生产是把水煤气中的混合气体经过处理后获得的较纯H2用于合成氨。合成氨反应原理为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。
2NH3(g) ΔH=-92.4 kJ·mol-1。实验室模拟化工生产,分别在不同实验条件下反应,N2浓度随时间变化如图甲所示。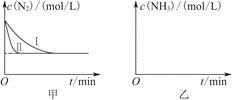
请回答下列问题:
①与实验Ⅰ比较,实验Ⅱ改变的条件为________________________________。
②实验Ⅲ比实验Ⅰ的温度要高,其他条件相同,请在图乙中画出实验Ⅰ和实验Ⅲ中NH3浓度随时间变化的示意图。