(共14分)下图为苯和溴的取代反应的改进实验装置图。其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入铁屑粉少量。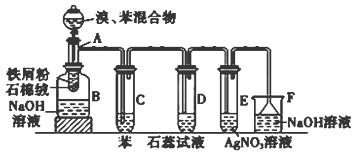
填写下列空白:(注:溴苯与NaOH溶液不可以发生水解反应)
(1)(每空2分)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中所发生反应的化学方程式(有机物写结构简式)_____________。
(2)(每空2分)试管C中苯的作用是______;反应开始后,观察D和E试管,看到的现象为D中_________;E中 ;
(3)(每空2分)反应2 min至3 min后,在B中的NaOH溶液可观察到的现象是 。
(4)(每空2分)在上述整套装置中,具有防倒吸的仪器有_______(填字母)
(5)(每空2分)改进后的实验除①步骤简单,操作方便,成功率高;②各步现象明显;③对产品便于观察这3个优点外,还有一个优点是_______________。
溴主要以Br-形式存在于海水中,海水呈弱碱性。工业上制备的Br2的操作步骤为:
①一定条件下,将Cl2通入浓缩的海水中,生成Br2
②利用热空气将Br2吹出,并用浓Na2CO3溶液吸收,生成NaBr、NaBrO3等
③用硫酸酸化步骤②得到的混合物
完成下列填空:
(1)Cl2氧化Br-应在 条件下进行,目的是为了避免 。
(2)Br2可用热空气吹出,其原因是 。
(3)写出步骤③所发生的化学反应方程式。
用硫酸而不用盐酸酸化的原因可能是 。步骤②的产品有时运输到目的地后再酸化,主要是因为 .
(4)为了除去工业Br2中微量的Cl2,可向工业Br2中 。
a.通入HBrb.加入Na2CO3溶液
c.加入NaBr溶液 d.加入Na2SO3溶液
现拟用图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有CuO粉末)中金属铜的含量
(1)制备一氧化碳的化学方程式是 ;
(2)试验中,观察到反应管中发生的现象是 ;尾气的主要成分是 ;
(3)反应完成后,正确的操作顺序为 (填字母)
a.关闭漏斗开关 b.熄灭酒精1 c.熄灭酒精灯2
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为 ;
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节) ;
②写出有关反应的化学方程式 .
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为 ;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为 。
(2)固体混合物B的组成为 ;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为 。
(3)完成煅烧过程中一个反应的化学方程式: CuO+ Al2O3 CuAlO2 + ↑。
CuAlO2 + ↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为 mol CuAlO2,至少需要1.0mol•L—1的Al2(SO4)3溶液 L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是 、过滤、洗涤和干燥。
已知:I2+2

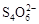 +2I―。相关物质的溶度积常数见下表:
+2I―。相关物质的溶度积常数见下表:
| 物质 |
Cu(OH)2 |
Fe(OH)3 |
CuCl |
CuI |
| Ksp |
2.2×10-20 |
2.6×10-39 |
1.7×10-7 |
1.3×10-12 |
(1)某酸性CuCl2溶液中含有少量的FeCl3,为得到纯净的CuCl2•2H2O晶体,加入 调至pH=4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中的c(Fe3+)=____________________;
过滤后,将所得滤液低温蒸发、浓缩结晶,可得到CuCl2•2H2O晶体。
(2)在空气中直接加热CuCl2•2H2O晶体得不到纯的无水CuCl2,原因是_______________。(用化学方程式表示)。由CuCl2•2H2O晶体得到纯的无水CuCl2的合理方法是_______。
(3)某学习小组用“间接碘量法”测定含有CuCl2•2H2O晶体的试样(不含能与I―发生反应的氧化性质杂质)的纯度,过程如下:取0.36 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。用0.1000 mol/L Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
①可选用___________作滴定指示荆,滴定终点的现象是_________________。
②CuCl2溶液与KI反应的离子方程式为______________________________。
③该试样中CuCl2•2H2O的质量百分数为___________________________。
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: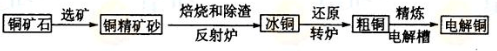
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主要反应的化学方程式分别是 、 ,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%--50%。转炉中,将冰铜加
熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O,生成Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是 、 ;
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极_ _(填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。