香叶醇是合成玫瑰香油的主要原料,其结构简式如下: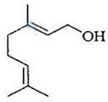
下列有关香叶醇的叙述正确的是
| A.香叶醇的分子式为C10H18O | B.不能使溴的四氯化碳溶液褪色 |
| C.不能使酸性高锰酸钾溶液褪色 | D.能发生加成反应不能发生取代反应 |
接触法制硫酸通常在400~500℃、常压和催化剂的作用下,用SO2与过量的O2反应生成SO3。2SO2(g)+O2(g) 2SO3(g)△H<0,在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件获得SO3 ,采取加压措施的目的
2SO3(g)△H<0,在上述条件下,SO2的转化率约为90%。但是部分发达国家采用高压条件获得SO3 ,采取加压措施的目的
| A.发达国家电能过量,以此消耗大量能源 |
| B.高压将使平衡向正反应方向移动,有利于进一步提高SO2的转化率 |
| C.加压可使SO2全部转化为SO3 ,消除SO2对空气的污染 |
| D.高压有利于加快反应速率,提高生产效率 |
一定温度下,在一容积固定的密闭容器中,建立了下列平衡:2NO2 N2O4,恒温下,再向容器通入一定量N2O4,重新建立平衡后,容器中N2O4的体积分数
N2O4,恒温下,再向容器通入一定量N2O4,重新建立平衡后,容器中N2O4的体积分数
| A.减少 | B.增大 | C.不变 | D.无法判断变化情况 |
在相同条件下(T=500K),有相同体积的甲、乙两密闭容器。甲容器中充入1 g SO2和1 g O2;乙容器中充入2 g SO2和2 g O2。下列叙述错误的是
| A.化学反应速率:乙>甲 |
| B.平衡后SO3的浓度:乙>甲 |
| C.SO2的转化率:乙>甲 |
| D.平衡后SO2的体积分数:乙>甲 |
人类将在二十一世纪大量使用氢气作燃料,其中最理想的获取氢气的途径是
| A.以焦炭和水制取水煤气后分离出氢气 |
| B.用铁、锌等活泼金属与稀硫酸制取氢气 |
| C.由火力发电厂提供电力电解水产生氢气 |
| D.利用高效催化剂和太阳能使海水分解产生氢气 |
某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如右图所示。下列说法正确的是()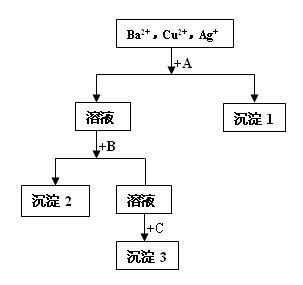
| A.试剂A为Na2SO4溶液 |
| B.沉淀3的化学式可能是BaSO4 |
| C.生成沉淀1的离子方程式为:Cu2+ + 2OH- = Cu(OH)2↓ |
| D.生成沉淀2的离子方程式为:Ag++ Cl- = AgCl↓ |