下列有关因果关系的描述正确的是
| A.因为盐酸的酸性强于氢硫酸,所以氯元素的非金属性强于硫 |
| B.因为醋酸电离吸热,所以用NaOH溶液恰好中和等体积等浓度的醋酸和盐酸,前者放出热量少 |
C.钠的金属性比钾强,工业上用钠制取钾(Na+KCl K↑+NaCl) K↑+NaCl) |
| D.因为某吸热反应能自发进行,所以该反应是熵减反应 |
将过氧化钠和过量的碳酸氢钠在密闭容器中混合充分加热后,最终残留固体物质是
| A.Na2CO3 | B.Na2O和Na2O2 |
| C.Na2O2 | D.Na2O2和Na2CO3 |
除去下列括号内杂质的试剂或方法错误的是
| A.HNO3溶液(H2SO4):适量BaCl2溶液,过滤 |
| B.CO2(SO2):酸性KMnO4溶液、浓硫酸,洗气 |
| C.KNO3晶体(NaCl):蒸馏水,结晶 |
| D.除FeCl2溶液中的少量FeCl3:足量铁屑, 过滤 |
配制一定物质的量浓度的NaOH溶液,下列操作正确的是
| A.称量时,将固体NaOH直接放在托盘天平的右盘上 |
| B.将NaOH固体在烧杯中溶解,所得溶液冷却到室温,再转移至容量瓶中 |
| C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 |
| D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线 |
下列制备和收集气体的实验装置合理的是 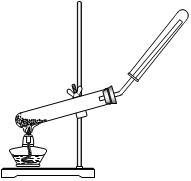
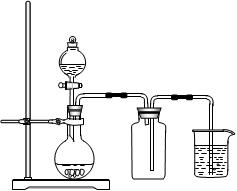
| A.用氯化铵和氢氧化钙制NH3 | B.用铜片和稀硝酸制NO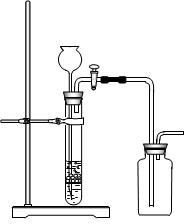 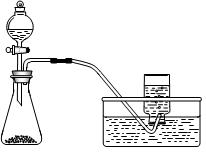 |
| C.用锌粒和稀硫酸制H2 | D.用双氧水和二氧化锰制O2 |
下列做法存在安全隐患的是
① 将水沿烧杯内壁缓缓加入浓硫酸中,用玻璃棒不断搅拌
② 实验室制取氯气时,尾气用碱液吸收
③ 取用金属钠或钾做完实验后,剩余的药品要放回原瓶
④ 干冰可用于钠、镁等金属的灭火
| A.①④ | B.①②③ | C.①③④ | D.全部 |