(13分)某研究性学习小组用下图装置进行SO2与FeCl3溶液反应的相关实验(夹持装置已略去)。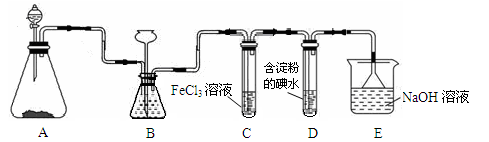
(1)在配制氯化铁溶液时,需先把氯化铁晶体溶解在 中,再加水稀释。
(2)下列实验方案适用于在装置A中制取所需SO2的是 。
a.Na2SO3固体与浓硝酸 b.Na2SO3固体与浓硫酸
c.CaSO3固体与稀硫酸 d.碳与热的浓硫酸
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择 。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(4)往FeCl3溶液中通入足量SO2,反应的离子方程式为 。
(5)能表明SO2的还原性强于I-的反应现象为__________________。
(6)装置E的作用为________________。
(7)在上述装置中通入过量的SO2,为了验证C中SO2与Fe3+发生了氧化还原反应,取C中的溶液,分成两份,并设计了如下实验:
方案①:往第一份试液中加入少量酸性KMnO4溶液,紫红色褪去。
方案②:往第二份试液加入KSCN溶液,不变红,再加入新制的氯水,溶液变红。
上述方案不合理的是 ,理由是 。
50mL 0.50mol/L盐酸跟50mL 0.55 mol/L NaOH溶液在右图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热。
(1)烧杯间填满泡沫塑料的作用是;
(2)大烧杯上若不盖硬纸板,求得的中和热数值(填“偏大”、 “偏小”、“无影响”)
(3)如下图所示,仪器A的名称是_______________;在实验过程中,如果不把温度计上的酸用水冲洗干净直接测量NaOH溶液的温度,则测得的△H-57.3KJ/mol(填“>”、“<”或“=”);
(4)实验中改用80mL 0.50mol/L盐酸跟100mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、“不相等”),
所求中和热(填“相等、“不相等”) 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会;(均填“偏大”、“偏小”、“无影响”)
(6)理论上稀强酸、稀强碱反应生成1mol水时放出57.3kJ的热量,写出稀硫酸和稀氢氧化钠溶液反应的中和热的热化学方程式;
(16分)(2011·黄冈中学质检)工业制备氯化铜时,将浓盐酸加热至80 ℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3]。请回答以下问题:
(1)第一步除去Fe2+,能否直接调整pH=9.6,将Fe2+沉淀除去?________,理由是________________________________________________________________________,
有人用强氧化剂NaClO将Fe2+氧化为Fe3+:
①加入NaClO后,溶液的pH变化是________(填代号)。
A.一定增大 B.一定减小
C.可能增大 D.可能减小
②你认为用NaClO作氧化剂是否妥当?________,理由是_____________________。
现有下列几种常用的氧化剂,可用于除去混合溶液中Fe2+的有________(有几个选几个)。
A.浓HNO3 B.KMnO4
C.Cl2 D.O2
E.H2O2
(2)除去溶液中Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有________。(多选不限)
A.NaOH B.氨水
C.Cu2(OH)2CO3 D.Na2CO3
E.CuO F.Cu(OH)2
(12分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ 称取样品1.500 g。
步骤Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容、充分摇匀。
步骤Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察________。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由________色变成______色。
(2)滴定结果如下表所示:
滴定次数待测溶液的体积/mL标准溶液的体积/mL
滴定前刻度滴定后刻度
1 25.00 1.02 21.03
2 25.00 2.00 21.99
3 25.00 0.20 20.20
若NaOH标准溶液的浓度为0.101 0 mol·L-1,则该样品中氮的质量分数为________。
(16分)已知金属活动相差越大,形成原电池时越容易放电。请根据如图装置,回答下列问题: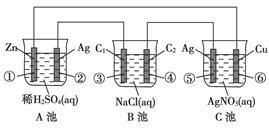
(1)各装置名称是:A池________,B池______,C池________。
(2)写出电极上发生的反应:①_____________,③___________,⑤_____________。
(3)当电路上有2 mol电子流过时,①极上质量变化______g,⑥极上质量变化______g。
(4)反应进行一段时间后,A、B、C三池中电解质溶液浓度不变的是________。
(12分)铁生锈是比较常见的现象,某实验小组为研究铁生锈的条件,设计了以下快速、易行的方法: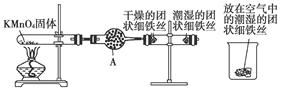
首先检查制取氧气装置的气密性,然后按上图所示连接好装置,点燃酒精灯给药品加热,持续3分钟左右,观察到的实验现象为:①直形导管中用蒸馏水浸过的光亮铁丝表面颜色变得灰暗,发生锈蚀;②直形导管中干燥的铁丝表面依然光亮,没有发生锈蚀;③烧杯中潮湿的铁丝表面依然光亮。
试回答以下问题:
(1)由于与金属接触的介质不同,金属腐蚀分成不同类型,本实验中铁生锈属于____________。
(2)仪器A的名称为____________,其中装的药品可以是________,其作用是________。
(3)由实验可知,该类铁生锈的条件为____________________________________ ____________________________________。
决定铁生锈快慢的一个重要因素是________。