工业上以氨气为原料(铂铑合金网为催化剂)催化氧化法制硝酸的过程如下: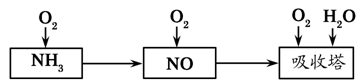
(1)已知反应一经发生,铂铑合金网就会处于红热状态。写出氨催化氧化的化学方程式:____________。
当温度降低时,化学平衡常数K值________(填“增大”、“减小”或“无影响”)。
(2)氨气是制取硝酸的重要原料,合成氨反应的化学方程式如下:N2+3H2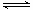 2NH3,该反应在固定容积的密闭容器中进行。
2NH3,该反应在固定容积的密闭容器中进行。
①下列各项标志着该反应达到化学平衡状态的是________(填字母)。
| A.容器内N2、H2、NH3的浓度之比为1∶3∶2 |
| B.v正(N2)=v逆(H2) |
| C.容器内压强保持不变 |
| D.混合气体的密度保持不变 |
②若在恒温条件下,将N2与H2按一定比例混合通入一个容积为2 L固定容积的密闭容器中,5 min后反应达平衡时,n(N2)=1.0 mol,n(H2)=0.8 mol,n(NH3)=0.8 mol,则反应速率v(H2)=________,平衡常数=________。
③若容器恒容、绝热,加热使容器内温度迅速升至原来的2倍,平衡将 (填“向左移动”、“向右移动”或“不移动”)。达到新平衡后,容器内温度 (填“大于”、“小于”或“等于”)原来的2倍。
A、B、C、D、E、F六种元素分属三个短周期,且原子序数依次增大。A、D同主族,可形成离子化合物X;B的氢化物与F的氢化物可反应生成离子化合物Y, 且B的单质是空气中含量最高的物质;C原子的最外层电子是次外层电子数的3倍;D、E、F 3种原子最外层共有11个电子, 且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水。
(1)B元素的名称是________,B单质的结构式为_____________。
(2)用电子式表示化合物X的形成过程__________________________________。
(3)化合物Y的电子式为_____________,A2C2的电子式为_____________。
(4)D、E最高价氧化物的水化物之间反应的离子方程式为___________。
拆开1mol H—H键,1mol N—H键,1mol N≡N键分别需要吸收的能量为436kJ,391kJ,946kJ:则(1)1mol N2完全反应生成NH3热量(填:吸收或放出)kJ;(2)理论上,每生成1mol NH3,热量(填:吸收或放出)kJ;(3)事实上,反应的热量总小于理论值,为什么?。
(1)下表中的实线表示元素周期表部分边界,请用实线画出周期表未完成的边界及金属元素与非金属元素的分界线。
(2)把符合下列要求的元素的元素符号标在表中对应位置处。
① 最高价氧化物的水化物碱性最强(放射性元素除外)
② 气态氢化物最稳定的非金属元素(3)元素在元素周期表中的位置与元素原子结构的关系_______________________ 。
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y |
Y是地壳中含量最高的元素 |
| Z |
Z的基态原子最外层电子排布式为3s23p1 |
| W |
W的一种核素的质量数为28,中子数为14 |
| T |
常温常压下,T单质是淡黄色固体,常在火山口附近沉积 |
| P |
P的价层电子排布为[Ar]3d104s2 |
(1)W位于元素周期表第________周期第________族;W的原子半径比X的________(填“大”或“小”)。
(2)TY2中心原子的杂化方式为_______;XY2中一个分子周围有__________个紧邻分子;堆积方式与XY2晶胞类型相同的金属有_________(从“Cu、Mg、K、Po”中选出正确的),其空间利用率为_______。
(3)Z的第一电离能比Mg的________(填“大”或“小”);写出Z单质与NaOH溶液反应的化学方程式 。
(4)写出W的最高价氧化物与NaOH溶液反应的离子方程式;W的最高价氧化物与XY2的熔点较高的是,原因是。
(5)处理含XO、TO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质T。已知:
① XO(g)+ 1/2O2(g)=XO2(g) ΔH="-283.0" kJ·mol-1② T(s)+O2(g)=TO2(g)ΔH="-296.0" kJ·mol-1
此反应的热化学方程式是______________________________。
(6)P在周期表的区;P和T形成的化合物PT在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方PT晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_________ g·cm-3(列式并计算)。
下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
| a |
b |
||||||||||||||||
| c |
d |
e |
|||||||||||||||
| f |
g |
||||||||||||||||
试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为,中心原子的杂化形式为;d的最高价氧化物的分子构型为,中心原子的杂化形式为,该分子是(填“极性”或“非极性”)分子。
(2)b、d、e三种元素的氢化物中的沸点最高的是,原因是:。
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式(必须将配位键表示出来)。
(4)f(NH3)5BrSO4可形成两种配合物 ,已知f 3+ 的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为,该配合物的配体是、;
(5)c单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
c单质晶体中原子的配位数为。若已知c的原子半径为r,NA代表阿伏加德罗常数,c的相对原子质量为M。该晶体的密度为(用字母表示)。