氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的价电子排布式是 。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4的结构式为 。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g)
若该反应中有4mol N-H键断裂,则形成的π键有 mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4与硫酸铵晶体类型相同,则N2H6SO4的晶体内不存在 。
A.离子键 B.共价键 C.配位键 D.范德华力
(3)FeCl3溶液与KSCN溶液混合,得到含多种配合物的红色溶液,其中配位数为5的配合物的化学式是 。KSCN中的阴离子与CO2互为等电子体,该阴离子的电子式是 。
(4)美国科学家合成了结构呈“V”形对称的N5+,已知该离子中各原子均达到8电子稳定结构。则有关该离子的下列说法中正确的是 。
A.每个N5+中含有35个质子和36个电子
B.该离子中有非极性键和配位键
C.该离子中含有2个π键
D.与PCl4+互为等电子体
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。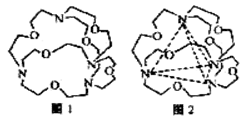
下列分子或离子中,能被该有机化合物识别的是_________(填标号)。
a.CF4 b.CH4 c.NH4+ d.H2O
(6)N的最高价氧化物为无色晶体,它由两种离子构成:已知其阴离子构型为平面正三角形,则其阳离子的构型为 形,阳离子中氮的杂化方式为 。
硫酸的性质有:
| A.强酸性; | B.吸水性; | C.脱水性; | D.强氧化性。在下列硫酸的用途或化学反应中,硫酸可能表现上述的一个或者多个性质,试用字母填空: |
(1)实验室干燥氢气___________________;
(2)浓硫酸与金属铜的反应________________;
(3)实际生产中,浓硫酸可用钢瓶贮运_________;
(4)浓硫酸使蔗糖变黑,且有刺激性气味的气体产生_______________。
已知:2KMnO4+16HCl(浓) ==2KCl+2MnCl2+5Cl2↑+8H2O,在该反应中,作为氧化剂的物质是,该反应中,盐酸体现的性质是、;若有1molKMnO4参与了反应,则转移电子的物质的量为。
在150℃,101 kPa下由CO、H2组成的混合气体共6 g,其相对氢气的密度为7.5,将该气体 在充足的氧气中完全燃烧后的产物通过足量的Na2O2粉末,使Na2O2粉末增重的质量为g,燃烧消耗的氧气在标准状况下的体积应是
在充足的氧气中完全燃烧后的产物通过足量的Na2O2粉末,使Na2O2粉末增重的质量为g,燃烧消耗的氧气在标准状况下的体积应是 L。
L。
(1) 5molCO2的质量是 g;在标准状况下所占的体积约为 L;所含的分子数目约为个。
(2) 4.5 g水与g硫酸所含的分子数相等,它们所含氧原 子数之比是。
子数之比是。
(3)将质量比为14﹕15的N2和NO混合,则混合气体中N2和NO的物质的量之比为,氮原子和氧原子的个数比为。
在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中;
(1)是氧化剂,是氧化产物。(均填写化学式)
(2)请用双线桥(或单线桥)法标出电子转移方向和数目
3Cu + 8HNO3(稀) =====3Cu(NO3)2+ 2NO↑ + 4H2O
+ 8HNO3(稀) =====3Cu(NO3)2+ 2NO↑ + 4H2O
(3)若产生的气体在标准状况下的体积为44.8 L,则反应中电子转移了mol。