下列变化中,属于化学变化的是
| A.用苯从溴水中萃取溴 | B.重油裂化得到轻质燃料油 |
| C.从煤焦油中提取苯、甲苯、二甲苯 | D.石油分馏得到汽油、煤油等产物 |
维通橡胶是一种耐腐蚀、耐油、耐高温、耐寒性能都较好的氟橡胶。它的结构简式为: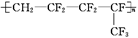 合成它的单体为
合成它的单体为
| A.氟乙烯和全氟异丙烯 | B.1,1-二氟乙烯和全氟丙烯 |
| C.1-三氟甲基-1,3-丁二烯 | D.全氟异戊二烯 |
心酮胺是治疗冠心病的药物。它具有如下的结构简式:下列关于心酮胺的描述,错误的是: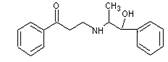
| A.可以在催化剂作用下和溴反应 | B.可以和银氨溶液发生银镜反应 |
| C.可以和氢气发生加成反应 | D.可以和浓硫酸与浓硝酸的混合液反应 |
玉米秸秆往往被当着燃料、饲料和有机肥使用,其实玉米秸秆可以在一定条件下水解生成葡萄糖,有着更高的经济价值,其实验包括下列一些操作步骤,正确的排列顺序是
①取少许玉米秸秆粉碎 ②小火微热,使之成为溶液 ③加90%的浓硫酸,用玻璃棒把秸秆粉末捣成糊④稍冷,滴入几滴硫酸铜溶液,并加入过量的NaOH溶液中和至出现氢氧化铜沉淀 ⑤加热煮沸
| A.①②③④⑤ | B.①③②④⑤ | C.①③②⑤④ | D.①②③⑤④ |
某工厂用CaSO4、NH3、H2O、CO2制备(NH4)2SO4,其工艺流程如下:
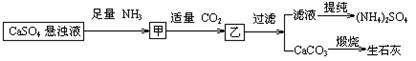
下列推断不合理的是
| A.往甲中通适量CO2有利于(NH4)2SO4生成 |
| B.生成1mol(NH4)2SO4至少消耗2 NH3 |
| C.CO2可被循环使用 |
| D.直接蒸干滤液能得到纯净的(NH4)2SO4 |
下列关于化工生产原理的叙述,符合目前工业生产实际情况的是
| A.石油工业中采用干馏的方法把石油分成不同沸点范围的产品 |
| B.氯气和氢气混和在光照条件下生成氯化氢,用水吸收成盐酸 |
| C.二氧化硫在接触室被氧化成三氧化硫,在吸收塔内被水吸收制成浓硫酸 |
| D.合成氨工业中,由于N2、H2可循环使用,所以总体来说氨的产率较高 |