铅蓄电池是典型的可充电电池,它的正负极隔板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42- 2PbSO4+2H2O(如图),则下列说法正确的是
2PbSO4+2H2O(如图),则下列说法正确的是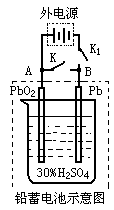
| A.放电时负极反应是:Pb-2e-=Pb2+,充电是阴极反应是:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
| B.闭合K断开K1,电流的流动方向是从B到A |
| C.放电过程中,溶液的pH不断减小 |
| D.放电时,线路上若有1mole-通过,则消耗硫酸也是1mol |
设NA为阿伏加德罗常数的值。下列说法一定正确的是
| A.25 ℃,pH=13的NaOH溶液中含有OH-为0.1NA |
| B.1 L 0.1 mol·L-1 CuSO4溶液中含有Cu2+为0.1NA |
| C.2.24 L N2和NH3混合气体中原子间含有的共用电子对数目为0.3NA |
| D.2 mol SO2和1 mol O2在一定条件下充分反应后,所得混合气体的分子数大于2NA |
下列关于指定粒子构成的叙述中,不正确的是
| A.37Cl与39K具有相同的中子数 |
B.第114号元素的一种核素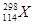 与 与 具有相同的最外层电子数 具有相同的最外层电子数 |
| C.H3O+与OH-具有相同的质子数和电子数 |
D.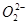 与S2-具有相同的质子数和电子数 与S2-具有相同的质子数和电子数 |
元素的原子结构决定其性质和在周期表中的位置,下列说法中正确的是
| A.元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 |
B.某微粒的结构示意简图为 ,则该元素在周期表中位于第三周期、ⅥA族 ,则该元素在周期表中位于第三周期、ⅥA族 |
C.过氧化氢电子式: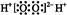 |
D. 和 和 互为同位素 互为同位素 |
元素A的阳离子aAm+与元素B的阴离子bBn-具有相同的电子层结构。以下关于A、B元素性质的比较中,正确的是
①原子序数:A>B
②离子半径:aAm+<bBn-
③原子半径:A<B
④元素所在的周期数:A>B
⑤A的最高正价与B的最低负价的绝对值相等
⑥b=a+m-n
A.②③④B.①②④C.④⑤⑥D.②⑤⑥
两种元素原子的核外电子层数之比与最外层电子数之比相等,则在周期表的前10号元素中,满足上述关系的元素共有
| A.1对 | B.2对 | C.3对 | D.4对 |