实验小组研究碳酸钠和碳酸氢钠的性质。
实验一:甲、乙、丙三位同学分别用溶质质量分数为5%的NaHCO3溶液和Na2CO3溶液进行了如下实验。
| 实验内容 |
NaHCO3溶液 |
Na2CO3溶液 |
| (1)加入无色酚酞溶液 |
溶液变红 |
溶液变红 |
| (2)加入澄清石灰水 |
产生白色沉淀 |
现象Ⅰ |
| (3)加入5%的CaCl2溶液 |
产生白色沉淀、有气泡产生 |
产生白色沉淀 |
| (4)加入稀盐酸 |
现象Ⅱ |
有气泡产生 |
| (5)加热溶液,并用导管与澄清石灰水连接 |
石灰水变浑浊 |
石灰水无明显变化 |
(1)表中的现象Ⅰ为 ;用化学方程式表示现象Ⅱ的原因 。
(2)若要鉴别实验中用到的NaHCO3和Na2CO3两种溶液,实验一中提供了 种方法。
实验二:甲、乙、丙三位同学分别将各自实验一中NaHCO3溶液与澄清石灰水反应后的物质进行过滤,对滤液中的溶质成分进行了如下探究。
【查阅资料】
(1)氯化钙溶液显中性,与氢氧化钠溶液不反应。
(2)两种溶液的取用量不同,滤液中溶质的组成情况可能有:①NaOH;②Na2CO3;③NaOH和Ca(OH)2;④Na2CO3和NaHCO3;⑤Na2CO3和NaOH。
【进行实验】
| |
实验操作 |
实验现象 |
实验结论 |
| 甲同学 |
取少量滤液于试管中,滴加足量的稀盐酸 |
有气泡产生 |
滤液中的溶质一定含有Na2CO3 |
| 乙同学 |
取少量滤液于试管中,向其中通入少量CO2 |
产生白色沉淀 |
则滤液中的溶质是 |
| 丙同学 |
取少量滤液于试管中,塞紧胶塞,并用导管与澄清石灰水连接,加热 |
澄清石灰水变浑浊 |
则滤液中的溶质是Na2CO3和NaHCO3 |
【反思与评价】
(1)根据丙同学的结论,NaHCO3溶液与澄清石灰水反应的化学方程式是 。
(2)甲同学进一步实验,确定了滤液中的溶质是Na2CO3和NaOH。其实验方案是 。
B.[实验化学]铝镁加(Almagate)是一种制酸药,其组成为Al2Mg6(OH)14(CO3)2·4H2O,实验室可通过下列实验制备铝镁加。
步骤1.称取63.5gMgSO4·7H2O(0.26mol),30.5gAl2(SO4)3·18H2O(0.046mol) 溶于400mL水中得到混合溶液A,另称取无水Na2CO352g溶于400mL水得到溶液B。
步骤2.将A、B两溶液同时等速滴加到盛有400mL90℃水的2L三颈烧瓶中,维持90℃,不断搅拌。
步骤3.抽滤,并用蒸馏水洗涤沉淀3~4次,100℃下干燥5h,得白色疏松固体24.3g。
(1)步骤2需缓慢滴加两种溶液并不断搅拌,其主要原因是 。
(2)①步骤3抽滤时用到的硅酸盐质仪器有 、 。
②如何证明沉淀已洗涤干净 。
(3)本次实验所得产品产率为 。
(4)铝镁加中和胃酸的离子方程式为 。
常温下钛的化学活性很小,在较高温度下可与多种物质反应。工业上由金红石(含TiO2大于96%)为原料生产钛的流程如下:
(1)TiCl4遇水强烈水解,写出其水解的化学方程式 。
(2)①若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是 。
②Cl2含量检测仪工作原理如下图,则Cl2在Pt电极放电的电极反应式为 。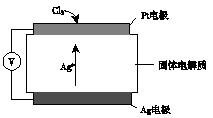
③实验室也可用KClO3和浓盐酸制取Cl2,方程式为:KClO3 + 6HCl(浓) =" KCl" + 3Cl2↑ + 3H2O。
当生成6.72LCl2(标准状况下)时,转移的电子的物质的量为 mol。
(3)一定条件下CO可以发生如下反应:4H2(g)+2CO(g)  CH3OCH3(g)+H2O(g) △H。
CH3OCH3(g)+H2O(g) △H。
①该反应的平衡常数表达式为K= 。
②将合成气以n(H2)/n(CO)=2通入1 L的反应器中,CO的平衡转化率随温度、压强变化关系如图所示,下列判断正确的是 (填序号)。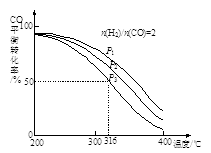
a.△H <0
b.P1<P2<P3
c.若在P3和316℃时,起始时n(H2)/n(CO)=3,则达到平衡时,CO转化率小于50%
③采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H2制备二甲醚(简称DME)。观察下图回答问题。
催化剂中n(Mn)/n(Cu)约为 时最有利于二甲醚的合成。
硫代硫酸钠(Na2S2O3)是最重要的硫代硫酸盐,俗称“海波”,又名“大苏打”。易溶于水,不溶于乙醇。在棉织物漂白、定量分析中有广泛应用。
某校化学研究性学习小组运用类比学习的思想,通过实验探究Na2S2O3的化学性质。
【样品制备】实验室中常用亚硫酸钠和硫磺制备Na2S2O3·5H2O。写出反应的化学方程式 ;
反应液经脱色、过滤、浓缩结晶、过滤、洗涤、干燥即得产品。所得晶体用乙醇洗涤的目的是 ;
【提出问题】Na2S2O3是否与Na2SO4具备相似的下列性质呢?
猜想①: ;
猜想②:溶液呈中性,且不与酸反应;
猜想③:无还原性,不能被氧化剂氧化。
【性质探究】基于上述猜想②、③,设计实验方案。
| 实验操作 |
实验现象或 预期实验现象 |
现象解释(用 离子方程式表示) |
|
| 猜想② |
,将试纸与标准比色卡对照 |
溶液pH=8 |
|
| 向pH=2的硫酸中 滴加Na2S2O3溶液 |
2S2O32- +2H+══ S↓+SO2↑+H2O |
||
| 猜想③ |
向新制氯水中滴加少量Na2S2O3溶液 |
氯水颜色变浅 |
【实验结论】
Na2S2O3能与酸反应,具有还原性,与Na2SO4的化学性质不相似。
【问题讨论】
(1)甲同学向探究“猜想③”反应后的溶液中滴加硝酸银溶液,观察到有白色沉淀产生,并据此认为氯水可将Na2S2O3氧化。你认为该方案是否正确并说明理由: 。
(2)请重新设计一个实验方案,证明Na2S2O3具有还原性。你的实验方案是: 。
(12分)以Al(OH)3、H2SO4、工业(NH4)2SO4(含FeSO4)为原料制备透明氧化铝陶瓷的工艺流程如下: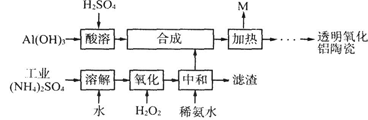
回答下列问题:
(1)酸溶时为了使氢氧化铝充分反应可以采取的措施为 ;酸溶的离子方程式为 。
(2)氧化时发生的主要反应的离子方程式 ;滤渣的主要成分为 (填化学式)。
(3)在合成步骤中生成硫酸铝铵[NH4Al(SO4)2],加热时没有电子转移,则M含有的主要物质的化学式为 ,M可用水或硫酸吸收转化为 (填化学式)以实现循环利用。
B.《实验化学》甲苯氧化法制备苯甲酸的反应原理如下: + 2KMnO4
+ 2KMnO4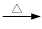
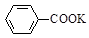 +KOH+2MnO2↓+H2O
+KOH+2MnO2↓+H2O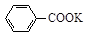 + HCl
+ HCl
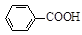 +KCl
+KCl
实验时将一定量的甲苯和KMnO4溶液置于图1装置中,在100 ℃时, 反应一段时间,再停止反应,并按如下流程分离出苯甲酸和回收未反应的甲苯。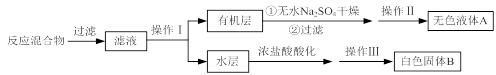
(1)实验室中实现操作Ⅰ所需的玻璃仪器有 、烧杯;操作Ⅱ的名称为 。
(2)如果滤液呈紫色,要先加亚硫酸氢钾,然后再加入浓盐酸酸化,若无此操作会出现的危害是 。
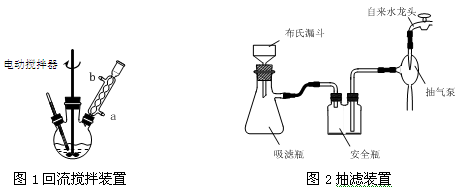
(3)在操作Ⅲ中,抽滤前需快速冷却溶液,其原因是 ;如图2所示抽滤完毕,应先断开 之间的橡皮管。
(4)纯度测定:称取1.220 g产品,配成100 mL溶液,取其中25.00 mL溶液,进行滴定 ,消耗KOH物质的量为2.4×10-3 mol。产品中苯甲酸质量分数为 。