下列四个实验方案的设计中,方案1合理、方案2不合理的是
| 选项 |
A |
B |
C |
D |
| 实验 目的 |
除去氢氧化钠中少量的碳酸钠 |
清洗铁制品表面的铁锈 |
鉴别稀盐酸和氯化钠溶液 |
检验一氧化碳中是否混有二氧化碳气体 |
| 方案1 |
加水溶解 |
加适量稀盐酸 |
加锌粒 |
点燃 |
| 方案2 |
加稀硫酸 |
用水洗涤 |
加石蕊溶液 |
通入澄清石灰水 |
下列实验事故处理的方法中,不正确的是
| A.不慎把浓硫酸粘在手上,立即用大量的水冲洗,涂上3%﹣5%的碳酸氢钠溶液 |
| B.如果汽油,煤油等可燃物着火,应立即用水扑灭 |
| C.不慎将浓碱沾到皮肤上,立即用大量的水冲洗,然后涂上硼酸溶液 |
| D.酒精灯不慎碰翻着火,应立即用湿布盖灭 |
已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是
| A.16g | B.32g | C.64g /mol | D.32g /mol |
下列物质按照单质、化合物、混合物顺序排列,其中物质类型排列顺序正确的是
| A.氯水、氯化钾、胆矾 |
| B.液溴、水和冰混合、澄清石灰水 |
| C.氮气、净化后的空气、氧化镁 |
| D.白磷、生锈的铁钉、高锰酸钾充分加热后的剩余固体 |
在酸性溶液中,能大量共存的离子组是
| A.K+、OH-、S042- | B.Cl-、N03-、Cu2+ |
| C.Al3+、C032-、Na+ | D.Ca2+、HC03-、NH4+ |
下列变化需要加入还原剂才能实现的
A.MnO4-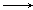 Mn2+ Mn2+ |
B.HCl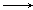 Cl2 Cl2 |
C.Fe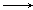 Fe3+ Fe3+ |
D.KClO3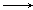 O2 O2 |