下列化学方程式书写正确的是
A.P + O2 P2O5 P2O5 |
B.4Fe + 3O2 2Fe2O3 2Fe2O3 |
C.2KMnO4 K2MnO4 + MnO2 +O2↑ K2MnO4 + MnO2 +O2↑ |
| D.2Fe+3H2SO4═Fe2(SO4)3+H2↑ |
在KI溶液中存在下列平衡:I2(aq)+I-(aq)=I3-(aq)。测得不同温度下该反应的平衡常数K如表所示:
| t/℃ |
5 |
15 |
25 |
35 |
50 |
| K |
1 100 |
841 |
689 |
533 |
409 |
下列说法正确的是( )。
A.反应I2(aq)+I-(aq)  I3-(aq)的ΔH>0
I3-(aq)的ΔH>0
B.其他条件不变,升高温度,溶液中c(I3-)减小
C.该反应的平衡常数表达式为K=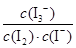
D.25 ℃时,向溶液中加入少量KI固体,平衡常数K小于689
一定条件下,在密闭容器中,能表示反应X(g)+2Y(g) 2Z(g)一定达到化学平衡状态的是( )。
2Z(g)一定达到化学平衡状态的是( )。
①X、Y、Z的物质的量之比为1∶2∶2 ②X、Y、Z的浓度不再发生变化 ③容器中的压强不再发生变化 ④单位时间内生成n mol Z,同时生成2n mol Y
| A.①② | B.①④ | C.②③ | D.③④ |
下列条件一定能使反应速率加快的是( )。
①增加反应物的物质的量 ②升高温度 ③增大反应体系的压强 ④不断分离出生成物 ⑤加入MnO2
| A.全部 | B.①②⑤ | C.② | D.②③ |
已知反应4NH3+5O2 4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是( )。
4NO+6H2O,若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则下列正确的关系是( )。
A.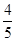 v(NH3)=v(O2) v(NH3)=v(O2) |
B.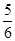 v(O2)=v(H2O) v(O2)=v(H2O) |
C. v(NH3)=v(H2O) v(NH3)=v(H2O) |
D.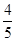 v(O2)=v(NO) v(O2)=v(NO) |
化学平衡常数可以用K来表示,下列关于化学平衡常数的说法中正确的是( )。
| A.K越大,反应物的转化率越小 |
| B.K与反应物的浓度有关 |
| C.K与生成物的浓度有关 |
| D.K与温度有关 |