课本上有8个“基础实验”,以提升同学们的实验能力,以下叙述正确的是
| A.“粗盐的初步提纯”实验中,持续加热食盐溶液直至水分蒸干 |
| B.“氧气的制取与性质”实验中,做铁丝燃烧实验的集气瓶内要预留少量的水 |
| C.“溶液的酸碱度”实验中,将pH试纸伸入溶液中测定酸碱度 |
| D.“酸与碱的化学性质”实验中,将实验废液直接倒入下水道 |
下列物质能使品红溶液褪色,且褪色原理基本相同的是()
①活性炭;②氯水;③二氧化硫;④臭氧;⑤过氧化钠;⑥双氧水
| A.①②④ | B.②③⑤ | C.②④⑤⑥ | D.①②③④⑤⑥ |
下列说法正确的是()
| A.SO2和SO3都是酸性氧化物,二者的水溶液都是强酸 |
| B.将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化 |
| C.硫粉在过量的纯氧中燃烧可以生成大量的SO3 |
| D.富含硫黄的矿物在工业上可用于制造硫酸 |
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是()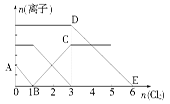
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)=6 mol/L |
| C.当通入Cl2 2 mol时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3 |
氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是()
| A.若管道漏气遇氨就会产生白烟 |
| B.该反应利用了Cl2的强氧化性 |
| C.该反应属于复分解反应 |
| D.生成1 mol N2有6 mol电子转移 |
氯气溶于水达到平衡后,若其他条件不变,只改变某一条件,下列叙述正确的是()
| A.再通入少量氯气,c(H+)/c(ClO-)减小 |
| B.通入少量SO2,溶液漂白性增强 |
| C.加入少量固体NaOH,一定有c(Na+)=c(Cl-)+c(ClO-) |
| D.加入少量固体NaOH,溶液的pH会略微增大 |