甲为人体吸入空气和呼出气体成分对比图。CO2含量变化真有这么大?

(1)利用图乙所示 法收集一瓶呼出的气体,标上A;取一个同样装有空气的集气瓶,标上B。将两根同样的小木条点燃后同时伸入A瓶和B瓶,A瓶中的木条先熄灭。这个实验现象 (选填“能”或“不能”)说明呼出的气体中二氧化碳更多。
(2)用大针筒将100ml人体呼出气体压入20ml澄清石灰水中(如图丙),澄清石灰水变浑浊;用同样的方法将100ml空气压入另一瓶20ml澄清石灰水中,请说出澄清石灰水是否变浑浊并解释原因: 。
下列说法正确的是▲(填序号)。
①由于碘在酒精中的溶解度大,所以可用酒精将碘水中的碘萃取出来
②水的沸点是100℃,酒精的沸点是78.5℃,用直接蒸馏法能使含水酒精变为无水酒精
③由于胶粒的直径比离子大,所以淀粉溶液中混有的碘化钾可用渗析法分离
④分离苯和苯酚的混合液,先加入适量浓溴水,再过滤、分液,即可实现
⑤由于高级脂肪酸钠盐在水中的分散质微粒直径在1nm~100 nm之间,所以可用食盐使高级脂肪酸纳从皂化反应后的混合物中析出
⑥不慎把苯酚溶液沾到皮肤上,应立即用酒精洗涤
⑦用稀溴水滴入苯酚溶液中制备2,4,6-三溴苯酚
⑧实验室使用体积比为1:3的浓硫酸与乙醇的混合溶液制乙烯时,为防加热时反应混合液出现暴沸现象,除了要加沸石外,还应注意缓慢加热让温度慢慢升至170℃
(15分) 化合物A(分子式为C9H9O2Br)在一定条件下有如下的转化关系,其中1mol C与Na完全反应生成1 mol H2,若与NaHCO3完全反应能产生1mol CO2,D和E互为同分异构体,但D可以使溴的四氯化碳溶液褪色,而E分子中有一个苯环和一个五元环。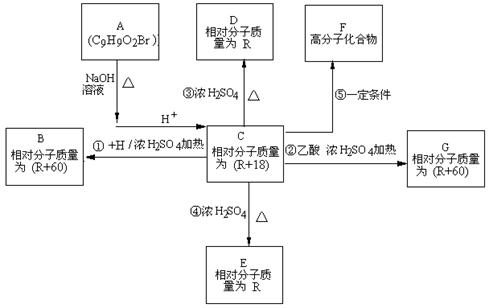
(1)写出A含有官能团的名称:;
(2)H可能是(写名称):__________________________________________________;
(3)写出反②、③的反应类型:②__________________、③__________________;
(4)写出E、G的结构简式EG;
(5)反应⑤的化学方程式:
(6)同时满足下列条件的C的同分异构体有_________ 种:
①能发生银镜反应;
②1mol该物质可以消耗3molNaOH;
③苯环上的一氯代物有3种。
(10分)化学原理常应用于工业生产,如氯碱工业和硫酸工业:
(1)氯碱工业用到的设备为离子交换膜电解槽,电解时阳极加入 ___________(填试剂名称),阴极产物为_________________(填化学式),电解的总反应方程式____________________________________________________.
(2)接触法制硫酸主要分成三步,第一步是煅烧黄铁矿,在___________中进行,第二步是催化氧化,发生反应的方程式___________________________________________,
第三步是吸收三氧化硫。取制备的少量硫酸用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液的体积为400mL,放出热量为Q kJ,写出表示该反应中和热的热化学方程式___________________________________________________。
)如图是氯化钠的晶胞示意图,回答如下问题: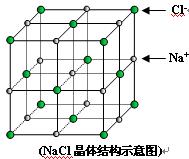
(1)在NaCl晶体中,与每个Cl-距离等同且距离最近的几个Na+所围成的空间几何构型为__________。
A.正四面体 B.正六面体 C.正八面体 D.正十二面体
(2)NaCl晶体中不存在分子,但是当温度达到1686 K时,NaCl晶体形成气体,并以分子形式存在。现有29.25 g NaCl晶体,强热使其气化,测的气体体积为5.6 L(已折算成标准状况)则此时氯化钠气体的化学式为_____________。
(3)随着科学技术的发展,阿伏加德罗常数的测定手段越来越多,测定的精确度也越来越高。现有一种简单可行的测定方法,具体步骤为:
①将固体NaCl细粒干燥后,准确称取a g NaCl固体并转移到定容容器A中;
②用滴定管向A仪器中加苯,不断振荡,继续加苯至A仪器的刻度,计算出NaCl固体的体积为V cm3。步骤①中A仪器最好使用_______________。
A.量筒 B.烧杯 C.容量瓶 D.试管
(4)已知NaCl晶体中,距离最近的Na+与Cl-间的平均距离为b cm,用上述测定方法测得的阿伏加德罗常数NA的表达式为______________________。(用含V、a、b的代数式表示)
下列有关化学实验操作正确的是_______________(填序号)
①实验室用盛装饱和碳酸钠溶液的试管收集乙酸乙酯
②为证明淀粉水解完全,取少量反应混合物,先加NaOH溶液中和硫酸,再加入新制氢氧化铜悬浊液并加热,有红色沉淀生成。
③验证RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再加入硝酸银溶液。
④实验室用无水乙醇和浓硫酸共热制乙烯时,把温度计水银球插入液面以下。
⑤向皂化反应后的溶液中加入食盐,静置后进行分液操作得到肥皂。