下列装置或操作能达到实验目的的是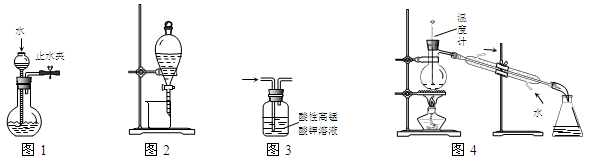
| A.图1所示装置可检查装置气密性 |
| B.图2所示装置可从碘的CCl4溶液中分离出碘 |
| C.图3所示装置可除去甲烷中乙烯 |
| D.图4所示装置可分离甲苯与乙醇 |
用如图示的方法可以保护钢质闸门.下列说法正确的是()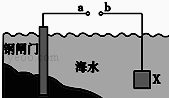
| A.当a、b间用导体连接时,则X应发生氧化反应 |
| B.当a、b间用导体连接时,则X可以是锌或石墨 |
| C.当a、b与外接电源相连时,a应连接电源的正极 |
| D.当a、b与外接电源相连时,阴极的电极反应式:2Cl﹣﹣2e→Cl2↑ |
全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如图所示,该电池放电时,右槽中的电极反应为V2+-e-=V3+,下列说法正确的是()
| A.放电时,右槽发生还原反应 |
| B.放电时,左槽电解液pH升高 |
| C.充电时,阴极的电极反应式:VO2++2H++e-=VO2++H2O |
| D.充电时,每转移1 mol电子,n(H+)的变化量为1 mol |
下列说法正确的是()
| A.由图甲可知,升高温度醋酸钠的水解程度增大 |
| B.由图乙可知,a点Kw的数值比b点Kw的数值大 |
C.由图丙可知,反应A(g)+B(g) 2C(g)是吸热反应 2C(g)是吸热反应 |
| D.由图丁可知,反应C(金刚石,s) = C(石墨,s)的焓变△H =△H1-△H2 |
用惰性电极电解一定浓度的硫酸铜溶液,长时间通电后,向所得溶液中加入0.2mol Cu(OH)2恰好恢复到电解前的浓度和pH.则电解过程中转移电子的总物质的量为()
| A.0.2mol | B.0.4mol | C.0.6mol | D.0.8mol |
物质的量浓度相同的下列溶液中:①NH4Cl ②(NH4)2CO3 ③(NH4)2SO4 ④NH4HSO4 ⑤NH4HCO3c(NH)由大到小的顺序是()
| A.⑤②③①④ | B.④①③②⑤ | C.③②①⑤④ | D.③②④①⑤ |