形成节约能源和保护生态环境的产业结构是人类与自然和谐发展的重要保证,你认为下列行为中有悖于这一保证的是
| A.开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料 |
| B.研究采煤、采油新技术,提高产量以满足工业生产的快速发展 |
| C.在农村推广使用沼气 |
| D.减少资源消耗、增加资源的重复使用和资源的循环再生 |
元素X的气态氢化物的化学式为H2X,则X最高价氧化物的水化物的化学式()
| A.H2XO3 | B.HXO4 | C.H3XO4 | D.H2XO4 |
下列说法正确的是()
A. 互称同位素 互称同位素 |
B.NH3的摩尔质量为17 |
| C.醋酸是强电解质 | D.分解反应一定不是氧化还原反应 |
水是国家战略性资源,下列物质对水质不会产生严重污染的是()
| A.CH3OH | B.SO2 | C.PbCl2 | D.CO2 |
在化学实验中,下列仪器不能加热的是()
| A.容量瓶 | B.圆底烧瓶 | C.锥形瓶 | D.蒸发皿 |
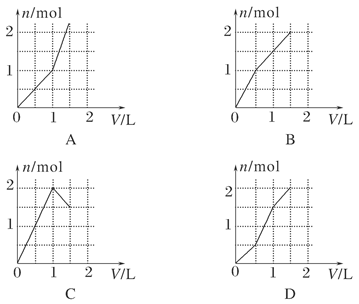
向含有1 mol HCl和1 mol MgSO4的混合溶液中加入1 mol/L Ba(OH)2溶液,下列图象能正确表示产生沉淀的物质的量(n)与加入Ba(OH)2溶液的体积(V)之间关系的是( )