在t℃时,10L 0.4mol·L-1H2O2溶液发生催化分解:2H2O2 = 2H2O + O2↑,不同时刻测得生成O2的体积如下表,已知反应至6min时,H2O2分解了50%(已折算为标准状况)
| t /min |
0 |
2 |
4 |
6 |
| V(O2)/L |
0.0 |
9.9 |
17.2 |
V=? |
下列叙述正确的是(溶液体积变化忽略不计)
A.0~2min H2O2平均反应速率比4~6min慢
B.反应至6min时,共产生O2 44.8L
C.0~6min的平均反应速率 v(H2O2)≈3.3×10-2mol·L-1·min-1
D.反应至6min时,c(H2O2) = 0.3mol·L-1
将钠投入到滴有石蕊试液的水中,下列有关现象的叙述中,错误的是()
| A.钠浮在水面上 | B.钠熔化成小球并在水面上游动 |
| C.有无色无味的气体生成 | D.水溶液变为红色 |
下列金属单质中,不能从CuCl2溶液中置换出铜的是()
| A.锌 | B.镁 | C.钠 | D.铁 |
研究物质性质的基本程序是一个系统化的过程,其主干可分为四个步骤。下列是研究物质性质的基本程序的第一步的是()
| A.预测物质的性质 | B.观察物质的外观性质 |
| C.进行实验和观察 | D.做出有关的解释和结论 |
按右图所示的方法研究某气体的性质,这种方法属于( )
| A.实验法 | B.观察法 |
| C.分类法 | D.比较法 |
下列说法中正确的是( )
| A.将0.1mol CuSO4·5H2O晶体加入到100 mL水中,该溶液物质的量浓度为1 mol∙L−1 |
| B.一定体积的浓硫酸(其中含0.2mol H2SO4)与足量的铜共热反应,生成SO2气体0.1mol |
| C.将34.2 g Al2(SO4)3溶于水配成100 mL溶液[Al2(SO4)3的相对质量为342],取出10 mL该溶液中Al3+浓度为1 mol∙L−1 |
D.KCl溶液的密度为1.174 g·cm−3,物质的量浓度为4.0 mol∙L−1,则此溶液中KCl的质量分数为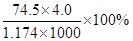 |