下表是元素周期表中的一部分,根据A~I在元素周期表中的位置,用元素符号或化学式回答下列问题:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 1 |
A |
|
|
|
|
|
|
|
| 2 |
|
|
|
D |
E |
|
G |
I |
| 3 |
B |
|
C |
|
F |
|
H |
|
(1)上表中,化学性质最不活泼的元素是_____,氧化性最强的单质是_____,还原性最强的是_____。
(2)最高价氧化物对应水化物的碱性最强的元素是________,酸性最强的元素是________。
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的是___________。
(4)请用电子式表示化合物BG的形成过程_________________________________。
(5)写出C的最高价氧化物对应水化物与B的最高价氧化物对应水化物反应的离子方程式:_______________________________________________________。
生态农业涉及农家肥料的综合利用。某种肥料经发酵得到一种含有甲烷、二氧化碳、氮气的混合气体8.96L(标准状况)。该气体通过盛有红色CuO粉末的硬质玻璃管,发生的反应为:CH4+4CuO CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入2L 0.1mol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
CO2↑+2H2O↑+4Cu。当甲烷完全反应后,硬质玻璃管的质量减轻了4.8g。将反应后气体通入2L 0.1mol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
(1) 原混合气体的物质的量是____________;生成沉淀的摩尔质量是____________。
(2) 原混合气体中甲烷的体积是____________。
(3) 求原混合气体中氮气的体积。
(第3小题请列式计算)
在花瓶中加入“鲜花保鲜剂”,能延长鲜花的寿命。下表是500mL“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g ·mol-1) |
| 蔗糖 |
25.00 |
342 |
| 硫酸钾 |
0.25 |
174 |
| 阿司匹林 |
0.17 |
180 |
| 高锰酸钾 |
0.25 |
158 |
| 硝酸银 |
0.02 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是________。
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)下列选项中,符合“鲜花保鲜剂”中K+(阿司匹林中不含K+)的物质的量浓度的试算式的是。
A.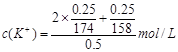
B. .
.
C.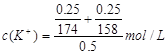
D.
(3)配制上述“鲜花保鲜剂”所需的仪器有:烧杯、玻璃棒、药匙、________________、______________、_______________。(在横线上填写所缺仪器的名称)
(4)在溶液配制过程中,下列操作对配制结果没有影响的是___________。
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
(1)含有相同氧原子数的CO和CO2,其质量比为;同温同压下的体积比为。
(2)标准状况下,CO2和CO的混合气体15g,体积为11.2L,则此混合气体对H2的相对密度是, CO2和CO的体积比为 。
(3)取1.43g Na2CO3·xH2O 溶于水配成10m L 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 2.0mL,并收集到112mL CO2(标况)。则稀盐酸物质的量浓度为; x=;
已知一个N2O3分子的质量为ag,一个N2O5分子的质量为bg,若以一个氧原子质量的1/16作为原子量的标准,则NO2的相对分子质量是____________(用a、b表示)
已知在标况下的四种气体①6.72L CH4 ②3.01×1023个HCl分子③13.6克H2S
④0.2molNH3用相应的序号填写下列空白:
(1)体积最大的是;(2)密度最大的是;
(3)质量最小的是;(4)含氢原子数最多的是。