甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g); △H=" +" 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g); △H=-192.9 kJ·mol-1
下列说法正确的是
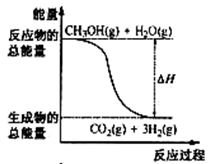
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
| B.反应①中的能量变化如上图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g) 的△H>-192.9kJ·mol-1 |
元素的性质呈周期性变化的根本原因是
| A.元素的相对原子质量的递增 |
| B.元素的原子半径呈周期性变化 |
| C.元素原子的最外层电子排布呈周期性变化 |
| D.元素的金属性和非金属性呈周期性变化 |
下列有关物质性质的比较中,不正确的是
| A.原子半径: Na>S>O |
| B.酸性强到弱: HIO4>HbrO4>HClO4 |
| C.碱性强到弱: KOH>NaOH>LiOH |
| D.金属性强到弱:Na>Mg>Al |
通常用来衡量一个国家石油化工发展水平标志的是
| A.甲烷的产量 | B.苯的产量 |
| C.乙醇的产量 | D.乙烯的产量 |
下列化学用语表示正确的是
A.氮原子结构示意图: |
| B.乙烯的结构式:CH2CH2 |
| C.含有10个中子的氧原子:1018O |
D.苯的结构简式: |
下列说法正确的是
| A.难失电子的原子,得电子的能力一定强 |
| B.最外层电子数大于4的,在化学反应中一般易得电子 |
| C.电子层结构相同的单核离子,阳离子半径一定比阴离子半径大 |
| D.任何原子的原子核都是由质子和中子构成的 |