下列有关化学概念或原理的论述中正确的是
| A.由SO2通入Ba(NO3)2溶液产生白色沉淀可知,BaSO3不溶于硝酸 |
| B.电解精炼铜,电解结束后电解质溶液浓度不变 |
| C.海水中Na+、Cl一结晶成NaCl的过程,形成了化学键 |
| D.任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
各组物质中,物质之间通过一步反应就能实现如图所示转化的是()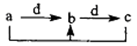
| a |
b |
c |
d |
|
| A |
Al |
Al(OH)3 |
NaAlO2 |
NaOH |
| B |
CH3CH2OH |
CH3CHO |
CH3COOH |
O2 |
| C |
Na2CO3 |
NaHCO3 |
NaOH |
CO2 |
| D |
Cl2 |
FeCl3 |
FeCl2 |
Fe |
对下列事实的解释错误的是()
| A.用75%的乙醇溶液进行消毒,是由于乙醇能使蛋白质变性 |
| B.医疗上用硫酸钡作“钡餐”,是由于硫酸钡难溶于水 |
| C.用氢氟酸雕刻玻璃,是由于氢氟酸能与二氧化硅反应 |
| D.向Na2O2与水完全反应后的溶液中加MnO2,产生O2,是由于该溶液中含H2O2下表 |
下列有关物质检验的实验结论正确的是( )
| 选项 |
实验操作及现象 |
实验结论 |
| A |
向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO42- |
| B |
向某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体 |
该溶液中一定含有HCO32- |
| C |
将某气体通入品红溶液中,品红溶液褪色 |
该气体一定是SO2 |
| D |
用玻璃棒蘸取浓氨水点到红色石蕊试纸上,试纸变蓝色 |
浓氨水呈碱性 |
文房四宝(笔、墨、纸、砚),做笔用的狼毫,研墨用的墨条以及宣纸(即白纸)和做砚台用的砚石的主要成份依次是()
| A.多糖、石墨、蛋白质、无机盐 | B.塑料、石墨、多糖、无机盐 |
| C.蛋白质、石墨、多糖、无机盐 | D.蛋白质、煤炭、多糖、有机机玻璃 |
关于氢键,下列说法正确的是
| A.每一个水分子内含有两个氢键 | B.冰、水和水蒸气中都存在氢键 |
| C.水的熔点比H2S高 | D.由于氢键作用,H2O是一种非常稳定的化合物 |