某未知溶液可能含Cl﹣、CO32﹣、Na+、SO42﹣、Al3+.将溶液滴在蓝色石蕊试纸上,试纸变红.取少量试液,滴加硝酸酸化的氯化钡溶液,有白色沉淀生成;在上层清液中滴加硝酸银溶液,产生白色沉淀.下列判断合理的是
| A.一定有Cl﹣ | B.一定有SO42﹣ |
| C.一定没有Al3+ | D.一定没有CO32﹣ |
一定条件下反应N2(g)+3H2(g) 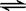 2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为
2NH3(g )在10L的密闭容器中进行,测得2min内,N2的物质的量由20mol减小到8mol,则2min内NH3的反应速率为
| A.1.2mol/(L·min) | B.1mol/(L·min) |
| C.0.6mol/(L·min) | D.0.4mol/(L·min) |
含硒(Se)的保健品已开始进入市场。已知硒与氧、硫同主族,与溴同周期,则下列关于硒的叙述中,正确的是
| A.非金属性比硫强 | B.氢化物比HBr稳定 |
| C.原子序数为34 | D.最高价氧化物的水化物显碱性 |
已知R2+离子核外有a个电子,b个中子。表示R原子符号正确的是
A.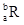 |
B.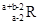 |
C.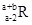 |
D.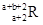 |
某主族元素R的最高正化合价与负化合价代数和为6,下列叙述正确的是:
| A.R一定是第VIIA族元素 | B.R的最高价氧化物为RO3 |
| C.R的气态氢化物能燃烧 | D.R的气态氢化物易溶于水显碱性 |
已知化学能与其他形式的能量可以相互转化,下列反应中能量的转化形式是由化学能转化为热能的是
A.CH4+2O2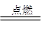 CO2+2H2O CO2+2H2O |
B.CaCO3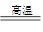 CaO+CO2↑ CaO+CO2↑ |
C.2H2O 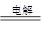 2H2↑ + O2↑ 2H2↑ + O2↑ |
D.Pb+PbO2+2H2SO4 2PbSO4+2H2O 2PbSO4+2H2O |