向某4L密闭容器中加入一定量的A、B、C三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示.乙图为达到平衡后在t2、t3、t4、t5时改变某一种反应条件,平衡体系中速率随时间变化的情况,且所改变的条件均不同.已知t3﹣t4阶段为使用催化剂.则下列说法不正确的是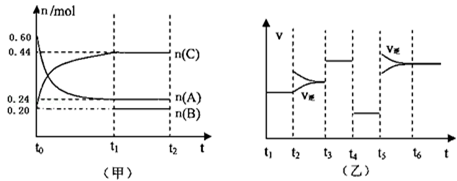
A.若t1=15s,则t0﹣t1阶段以A浓度变化表示的反应速率v(A)为0.006mol/(L•s)
B.B的起始物质的量为0.04mol
C.若t2﹣t3阶段改变的条件是增大A的浓度,则平衡时C的体积分数变大
D.该反应为放热反应
右图表示反应N2(g)+3H2(g) 2NH3(g)△H<0,在某一时间段中反应速率与反应过程的曲线关系图。下列说法正确的是
2NH3(g)△H<0,在某一时间段中反应速率与反应过程的曲线关系图。下列说法正确的是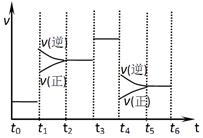
| A.氨气的体积分数最高的一段时间为t5~t6 |
| B.t2~t3和t3~t4时间段氨气的体积分数相等 |
| C.t1时刻改变的条件是降低温度 |
| D.t4~t5时间段平衡向正反应方向移动 |
室温下,水的电离达到平衡:H2O H++OH-。下列叙述正确的是
H++OH-。下列叙述正确的是
| A.将水加热,平衡向正向移动,Kw不变 |
| B.向水中加入少量NaOH固体,平衡向逆向移动,c(OH-)增大 |
| C.新制氯水久置后,水的电离平衡向正向移动,c(OH-)增大 |
| D.向水中加入少量CH3COONa固体,平衡向正向移动,Kw增大 |
下列物质属于强电解质的是
| A.NH3·H2O | B.H2O | C.CH3COOH | D.醋酸铵 |
改变反应容器体积使压强变化,但不会使下列化学反应的平衡发生移动的是
A.Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) 2Fe(s)+3CO2(g) |
B.3H2(g)+N2(g) 2NH3(g) 2NH3(g) |
C.2SO2(g)+O2(g) 2SO3(g) 2SO3(g) |
D.C(s)+CO2(g) 2CO(g) 2CO(g) |
已知H2+I2 2HI△H<0。有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2HI△H<0。有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
| A.甲、乙提高相同温度 |
| B.甲中加入0.1 molHe,乙不改变 |
| C.甲降低温度,乙不变 |
| D.甲增加0.1 molH2,乙增加0.1 mol I2 |