氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。
完成下列计算:
(1)CaCO3质量分数为0.90的石灰石100 kg完成分解产生CO2 L(标准状况)。石灰窑中,该石灰石100 kg与焦炭混合焙烧,产生CO2 29120 L(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为 mol。
(2)已知粗盐水含MgCl2 6.80 mol/m3,含CaCl2 3.00mol/m3。
向粗盐水中加入Ca(OH)2除镁离子:MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2
然后加入Na2CO3除钙离子。
处理上述粗盐水10 m3,至少需要加Na2CO3 g。
如果用碳酸化尾气(含NH3体积分数为0.100、CO2体积分数0.040)代替碳酸钠,发生如下反应:Ca2+ + 2NH3 + CO2 + H2O → CaCO3↓ + 2NH4+
处理上述10 m3粗盐水至少需要通入多少L(标准状况)碳酸化尾气?列式计算。
(3)某氨盐水含氯化钠1521 kg,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070 kg。列式计算:
①过滤后溶液中氯化钠的质量。
②析出的碳酸氢钠晶体的质量。
1774年,瑞典化学家舍勒发现软锰矿(主要成分是MnO2)和浓盐酸混合加热能制取氯气:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
现将含MnO2的质量为17.4g的软锰矿石与足量浓盐酸完全反应(杂质不参加反应)。计算:
(1)生成的Cl2的体积(标准状况)。
(2)参加反应的HCl的物质的量。
向100mLBaCl2、AlCl3和FeCl3的混合溶液A中,逐滴加入Na2SO4和NaOH的混合溶液B,产生的沉淀总物质的量和加入溶液B的体积关系如图所示: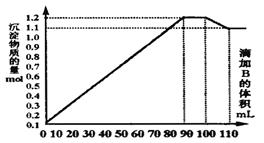
(1)当加入B溶液110 mL时,溶液中的沉淀是(填化学式)
(2)将A.B溶液中各溶质的物质的量浓度填入下表:
| 溶质 |
Na2SO4 |
BaCl2 |
AlCl3 |
FeCl3 |
| /mol·L-1 |
(3)写出滴加B溶液90-100mL时的离子方程式:
。
硝酸与金属反应时,浓度越稀还原产物价态越低。现用一定量的铝粉与镁粉组成的混合物与100ml硝酸钾 溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,相反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与与产生的沉淀质量的关系如图所示。
溶液与硫酸组成的混合溶液充分反应,反应过程中无任何气体放出,相反应后的溶液中逐滴加入4.00mol/L的NaOH溶液,加入的溶液体积与与产生的沉淀质量的关系如图所示。
回答下列问题:
(1)写出铝与混合溶液反应的离子方程式:
(2)参加反应硝酸根离子物质的量为mol
(3)参加反应的铝与镁的质量比为
(4混合液中硫酸的物质的量的浓度为mol /L
/L
现有含碳酸钠杂质的氯化钠样品10克,与足量的盐酸反应,生成的气体在标准状况下体积为224mL,求:
(1)生成的气体是______________,物质的量为____________。
(2)该样品中含氯化钠的质量分数?(写出计算过程)
(共10分)常温下,将20.0g14.0%的NaCl溶液跟30.0g24.0%的NaCl溶液混合,得到密度为1.15g/cm3的混合溶液。求: (1)、该混合溶液的质量分数?
(1)、该混合溶液的质量分数?
(2)该混合溶液的物质的量浓度?
(3)在1000g水中溶解多少摩尔NaCl才能使其浓度与上述溶液的浓度相等?