常温下,下列溶液中的微粒浓度关系正确的是
| A.新制氯水中加入固体NaOH:c(Na+)= c(Cl-)+ c(ClO-)+ c(OH‑) |
| B.pH = 8.3的NaHCO3溶液:c(Na+)> c(HCO3-)> c(CO32-)> c(H2CO3) |
| C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-)= c(NH4+)> c(OH‑)= c(H+) |
| D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)– 2c(OH-)= c(CH3COO-)– c(CH3COOH) |
用惰性电极实现电解,下列说法正确的是()
| A.电解稀硫酸溶液,实质是电解水,故溶液pH不变 |
| B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小 |
| C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比是1∶2 |
| D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1 |
能用电解原理说明的问题是( )
①电解是把电能转变成化学能
②电解是化学能转变成电能
③电解质溶液导电是化学变化,金属导电是物理变化
④不能自发进行的氧化还原反应,通过电解的原理可以实现
⑤任何溶液被电解时,必须导致氧化还原反应的发生
| A.①②③④ | B.②③⑤ | C.③④ | D.①③④⑤ |
500mLKNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol·L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是( )
| A.原混合溶液中c(K+)为2mol·L-1 |
| B.上述电解过程中共转移2mol电子 |
| C.电解得到铜的物质的量为0.5mol |
| D.电解后溶液中c(H+)为2mol·L-1 |
下列描述中,不符合生产实际的是
| A.电解熔融的氧化铝制取金属铝,用铁作阳极 |
| B.电解法精炼粗铜,用纯铜作阴极 |
| C.电解饱和食盐水制烧碱,用涂镍碳钢网作阴极 |
| D.在镀件上电镀锌,用锌作阳极 |
如图所示,各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是()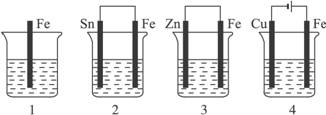
| A.4>2>1>3 | B.2>1>3>4 | C.4>2>3>1 | D.3>2>4>1 |