下列说法正确的一组是
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
③氯化钠水溶液在电流的作用下电离出Na+和Cl-,所以氯化钠是强电解质
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤熔融的电解质都能导电
⑥强电解质可能是离子化合物,也可能是共价化合物
| A.①③⑤⑥ | B.②④⑤⑥ |
| C.只有⑤ | D.只有⑥ |
中和热的测定实验中,可能用到下列仪器:
①托盘天平 ②量筒 ③烧杯 ④温度计 ⑤小试管 ⑥酒精灯。
其中应使用仪器的正确组合是
| A.①②⑤ | B.②③④ | C.②③⑥ | D.全部 |
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是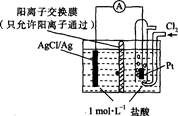
| A.正极反应为AgCl+e-═Ag+Cl- |
| B.放电时,交换膜右侧溶液中有大量白色沉淀生成 |
| C.若用NaCl溶液代替盐酸,则电池总反应随之改变 |
| D.当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子 |
一定条件下,2SO2(g)+O2(g) 2SO3(g)△H<0,有关叙述正确的是
2SO3(g)△H<0,有关叙述正确的是
| A.升高温度,v(正)变大,v(逆)变小 |
| B.恒温恒容,充人O2,02的转化率升高 |
| C.恒温恒压,充人N2,平衡不移动 |
| D.恒温恒容,平衡前后混合气体的密度保持不变 |
为了探索外界条件对反应aX(g)+bY(g) cZ(g)的影响,以X和Y的物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。以下判断正确的是
cZ(g)的影响,以X和Y的物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。以下判断正确的是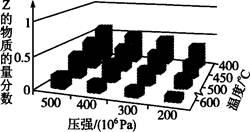
| A.△H>0,a+b>c | B.△H>0,a+b<c |
| C.△H<0,a+b>c | D.△H<0,a+b<c |
下列说法正确的是
| A.石墨比金刚石稳定,故石墨转化为金刚石的反应可以自发进行 |
| B.吸热反应能自发进行的原因是从外界获得了能量 |
| C.SiO2常温下可以与NaOH溶液和HF溶液反应,说明其具有两性 |
| D.反应A(g)+B(g)=2C(s)可以自发进行,则其必为放热反应 |