碱性电池具有容量大、放电电流大的特点,因而得到广泛使用,锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应为:ZN(s)+2MNO2(s)+H2O(l)﹦ZN(OH)2(s)+MN2O3(s)。下列说法错误的是
| A.电池工作时,锌失去电子 |
| B.电池正极的电极反应式为:2MNO2(s)+H2O(l)+2e-﹦MN2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
在氮的氧化物中,氮元素和氧元素的质量比是7∶12,则氮元素的化合价是()
| A.+4 | B.+2 | C.+3 | D.+5 |
a mol FeS与b mol FeO投入到V L、c mol·L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为()
①(a+b)×63 g②(a+b)×189 g③(a+b)mol④(Vc-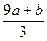 )mol
)mol
| A.①④ | B.②③ | C.①③ | D.②④ |
如下图所示,当向试管内通入21 mL O2时,最后试管中的液面仍在原来的位置,则原试管中NO为()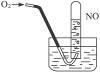
| A.6 mL | B.12 mL | C.16 mL | D.18 mL |
某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原的硝酸的物质的量之比为2∶1时,还原产物是()
| A.NO2 | B.NO | C.N2O | D.N2 |
把3体积NO2气体依次通过装有足量NaHCO3饱和溶液、浓H2SO4和Na2O2的3个装置,最后用排水法收集,假设氮的氧化物不与Na2O2反应,最后收集到_________________体积的气体,该气体的组成为________________。