(15分)某铜矿石的成分中含有Cu2O,还含有少量的Al2O3、Fe203和Si02。某工厂利用此矿石炼制精铜的工艺流程示意图如下:

已知:CuO2+2H+=Cu+Cu2++H2O
(1)滤液A中铁元素的存在形式为 (填离子符号),生成该离子的离子方程式为 ,检验滤液A中存在该离子的试剂为 (填试剂名称)。
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为 。
(3)常温下.等pH的NaAlO2和NaOH两份溶液中,由水电离出的c(OH一)前者为后者的108倍,则两种溶液的pH= 。
(4)将Na2CO3溶液滴入到一定量的CuCl2溶液中,除得到蓝色沉淀,还有无色无味气体放出,写出相应的离子方程式: 。
(5)①粗铜的电解精炼如图所示。在粗铜的电解精炼过程中,c为粗铜板,则a端应连接电源的 (填“正”或“负”)极,若粗铜中含有Au、Ag、Fe杂质,则电解过程中c电极上发生反应的方程式有 、 。

②可用酸性高锰酸钾溶液滴定法测定反应后电解液中铁元素的含量。滴定时不能用碱式滴定管盛放酸性高锰酸钾溶液的原因是 、滴定中发生反应的离子方程式为 ,滴定时.锥形瓶中的溶液接触空气,则测得铁元素的含量会 (填“偏高”或“偏低”)。
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 g NaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为 。若要计算该溶液的质量分数,还需要的一个条件是 (用文字说明)。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性; b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内反应的离子方程式为 。
吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(6)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏 b.蒸发浓缩 c.灼烧 d.过滤洗涤 e.冷却结晶
要得到更纯的NaClO2•3H2O晶体必须进行的操作是 (填操作名称)。
高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用。
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。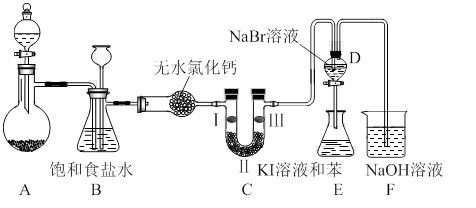
(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,相应的离子方程式为:。
(2)装置B的作用是,监测实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象。
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入。(选a或b或c)
| a |
b |
c |
|
| I |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
浓硫酸 |
无水氯化钙 |
| III |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
(4)设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴。打开活塞,将D中的少量溶液加入E中,振荡E。观察到的现象是。该现象(填“能”或“不能”)说明溴的非金属性强于碘,原因是。
二氧化氯(ClO2)是一种广谱、高效的杀菌消毒剂,有与氯气相似的强烈刺激性气味,易溶于水,沸点11℃,遇热不稳定易分解发生爆炸。一种工业制法用硫铁矿(主要成分为FeS2)还原氯酸钠制取二氧化氯,某研究小组在实验室设计如下装置制备ClO2的水溶液。
(1)三颈烧瓶中加入NaClO3溶液、浓H2SO4,通入空气,调节恒温器至60℃,通过固体加料器缓慢匀速加入硫铁矿粉末。反应开始时烧瓶内发生反应的离子方程式如下,请配平该方程式:□ClO3- +□FeS2+□H+=□ClO2+□Fe3++□SO42-+□H2O
(2)装置D的作用是。
(3)用上述反应完后的废液(除上述产物外,还有Al3+、Mg2+、H+、Cl-等)可制备摩尔盐,即(NH4)2Fe(SO4)2·6H2O。其操作流程如下: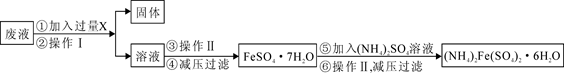
回答下列问题:
①操作Ⅰ的名称为:。
②试剂X是,写出发生的主要反应的离子方程式。
③为测定(NH4)2Fe(SO4)2·6H2O晶体中铁的含量,某实验小组做了如下实验:用电子天平准确称量5.000g硫酸亚铁铵晶体,配制成250mL溶液。取所配溶液25.00mL于锥形瓶中,加稀H2SO4酸化,用0.01000mol/LKMnO4溶液滴定至Fe2+恰好全部氧化成Fe3+,同时,MnO4_被还原成Mn2+。测得消耗KMnO4溶液的平均体积为21.00mL。则该晶体中铁的质量分数为。(保留4位有效数字)
硝基苯是重要的精细化工原料,是医药和染料的中间体,还可做有机溶剂。制备硝基苯的过程如下:①配制混酸:组装如下图反应装置。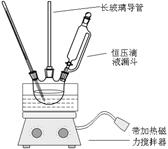
取100 mL烧杯,用20 mL浓硫酸与浓硝酸18 mL配制混和酸,加入漏斗中。把18 mL苯加入三颈烧瓶中。
②向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。
③在50-60℃下发生反应,直至反应结束。
④除去混和酸后,粗产品依次用蒸馏水和10%Na2CO3溶液洗涤,最后再用蒸馏水洗涤得到粗产品。
已知(1)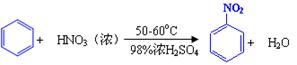

(2)可能用到的有关数据列表如下
| 物质 |
熔点/℃ |
沸点/℃ |
密度(20 ℃) / g·cm-3 |
溶解性 |
| 苯 |
5.5 |
80 |
0.88 |
微溶于水 |
| 硝基苯 |
5.7 |
210.9 |
1.205 |
难溶于水 |
| 1,3-二硝基苯 |
89 |
301 |
1.57 |
微溶于水 |
| 浓硝酸 |
 |
83 |
1.4 |
易溶于水 |
| 浓硫酸 |
 |
338 |
1.84 |
易溶于水 |
请回答下列问题:
(1)配置混酸应先在烧杯中先加入。
(2)恒压滴液漏斗的优点是。
(3)实验装置中长玻璃管可用代替(填仪器名称)。
(4)反应结束后产品在液体的层(填“上”或者“下”),分离混酸和产品的操作方法为。
(5)用10%Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净?。
(6)为了得到更纯净的硝基苯,还须先向液体中加入除去水,然后蒸馏,
无水硫酸铜受热分解生成氧化铜和气体,受热温度不同生成的气体成分也不同。气体成分可能含SO3、SO2和O2中的一种、两种或三种。某化学课外活动小组设计探究性实验,测定反应产生的SO3、SO2和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示:
【提出猜想】
猜想I.硫酸铜受热分解所得气体的成分可能只含SO3一种;
猜想Ⅱ.硫酸铜受热分解所得气体的成分可能只含_______两种。
猜想Ⅲ.硫酸铜受热分解所得气体的成分可能含有_______三种。
【实验探究】
已知实验结束时,硫酸铜完全分解。
(1)组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为①→⑨→⑩→⑥→⑤→____→_____→_____→______→②。(填接口序号)
(2)若实验结束时装置B中量筒没有收集到水,则证明猜想_______(填“I”“Ⅱ”或“Ⅲ’’)正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后,测得相关数据也不
同,数据如下:
请通过计算,推断出在第一小组和第二小组的实验条件下CuSO4分解的化学方程式:
第一小组:_____________________________________________________________;
第二小组:_____________________________________________________________。