【2015上海化学】将O2和NH3的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8mL气体。原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)
| A.231.5mL | B.268.8mL | C.287.5mL | D.313.6mL |
异烟肼F(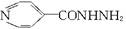 )是一种抗结核病药。关于F的以下说法不正确的是()
)是一种抗结核病药。关于F的以下说法不正确的是()
| A.F分子中的三个氮原子有可能共平面 |
| B.6个碳原子不可能在同一平面内 |
| C.此物质可发生水解 |
| D.此物质能与亚硝酸反应 |
钛(Ti)金属常被称为未来钢铁。钛元素的同位素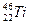 、
、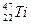 、
、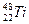 、
、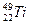 、
、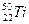 中,中子数不可能为( )
中,中子数不可能为( )
| A.30 | B.28 | C.26 | D.24 |
X元素的阳离子和Y元素的阴离子具有相同的核外电子层结构,下列叙述正确的是( )
| A.原子序数X<Y |
| B.原子半径X<Y |
| C.离子半径X>Y |
| D.原子最外层电子数X<Y |
C60与现代足球有很相似的结构,它与石墨互为( )
| A.同位素 | B.同素异形体 | C.同分异构体 | D.同系物 |
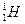 、
、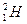 、
、 、H+、H2是( )
、H+、H2是( )
| A.氢的五种同位素 |
| B.五种氢元素 |
| C.氢的五种同素异形体 |
| D.氢元素的五种不同微粒 |